
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 4. коллоидные растворы
|
|
|
|
В а р и а н т 20
В а р и а н т 19
1. Ионные уравнения. Образование осадка. Произведение растворимости.
2. Гидролиз солей. рН растворов гидролизуемых солей.
3. Напишите в ионной форме следующие уравнения:
MgCl2 + KOH ®
AgNO3 + Na2CrO4 ®
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) магний иодида; б) калий силиката; в) аммоний сульфида.
5. К 100 мл 0,1 н. раствора HCOOH прилили 300 мл 0,2 н. раствора HCOOK. Вычислить рН образовавшегося буферного раствора. (Кд(HCOOH)=1,77×10-4).
1. Теория электролитической диссоциации. Диссоциация электролитов с различным характером его химических связей.
2. Гидролиз солей. Степень и константа гидролиза.
3. Напишите в ионной форме следующие уравнения:
ZnCl2 + NH4OH ®
AgNO3 + H3PO4 ®
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: а) барий нитрита; б) натрий сульфида; в) магний ацетата.
5. Вычислить рН 2 л буферного раствора, содержащего 140 г NH4OH и 214 г NH4Cl. (Кд(NH4OH)=1,79×10-5).
Система, в которой одно вещество раздроблено и распределено в массе другого вещества, называется дисперсной системой.
Вещество, распределенное в виде отдельных частиц (твердых частиц, капель жидкости, пузырьков газа и т. д.), называется дисперсной фазой. Вещество, в котором распределена дисперсная фаза, – дисперсионной средой. Дисперсная фаза нерастворима в дисперсионной среде и отделена от нее поверхностью раздела. Дисперсные системы различаются степенью дробления дисперсной фазы. Степень измельчения (дробления) вещества называется степенью дисперсности. По степени дисперсности дисперсные системы разделяются на три вида.
Дисперсные системы. (1 нм=10-9м)
1. Грубодисперсные (суспензии, эмульсии и т. д.) 100 нм
2. Коллоидные 1–100 нм
3. Молекулярно-ионные (истинные растворы) 1 нм
В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды грубодисперсные системы классифицируют следующим образом:
Суспензии – это системы, состоящие из твердых частиц, взвешенных в жидкости. Частицы твердого вещества видны в микроскоп и имеют размер 100–1000 нм. Суспензии (например, взвесь глины в воде) не фильтруются через бумажные фильтры, не обладают осмотическим давлением и являются седиментационно неустойчивыми, частицы дисперсной фазы выпадают на дно сосуда под действием тяжести.
Эмульсиями называются дисперсные системы, в которых дисперсная фаза и дисперсионная среда – жидкие. Для получения эмульсии необходимо взять две взаимно нерастворимые жидкости (или ограниченно нерастворимые) и диспергировать одну в другой в виде мелких капель. Например, эмульсия: масло в воде. Обычно одна из фаз эмульсий – вода, Другой фазой может быть любая органическая жидкость, нерастворимая в воде: масло, бензол, бензин и т. п. Для повышения устойчивости эмульсий вводят особые вещества, называемые эмульгаторами. Эмульгатор, адсорбируясь на поверхности капель дисперсной фазы, образует пленки, препятствующие слиянию капель друг с другом. В качестве эмульгаторов в большинстве случаев применяют соли высокомолекулярных жирных кислот – мыла.
Пенами называют высококонцентрированные связные дисперсные системы, в которых дисперсная фаза – газ, а дисперсионная среда – жидкость, вытянутая в тонкие пленки. Если эти пленки способны отвердеть, то можно получить практически безгранично устойчивую твердую пену (пенобетоны, пенопласты, микропористая резина и т. д.).
Дымы и туманы представляют собой дисперсные системы с газообразной дисперсионной средой. Дым – это твердые частицы, распределенные в газе, а туман – весьма мелкие капельки жидкости, также распределенные в газе. Устойчивые неоседающие дымы и туманы имеют весьма мелкие размеры частиц дисперсной фазы. Поэтому их объединяют под общим названием аэрозоли независимо от агрегатного состояния дисперсной фазы.
Коллоидные системы представляют собой вид дисперсных систем с размером частиц дисперсной фазы от 1 до 100 нм. Диспергирование (дробление) растворенного вещества в истинных растворах происходит до молекул и ионов. В коллоидных системах частицы дисперсной фазы представляют собой относительно крупные агрегаты, состоящие из сотен и тысяч молекул, ионов и атомов.
Жидкие коллоидно-дисперсные системы называются коллоидными растворами или золями. От истинных растворов коллоидные растворы отличаются рядом специфических свойств: они относительно неустойчивые, частицы дисперсной фазы не проходят через мембрану, обладают малой скоростью диффузии, способны рассеивать свет.
Если направить пучок света через коллоидный раствор, то частички растворенного вещества рассеивают свет, – в жидкости наблюдается светящийся конус (конус Тиндаля). Это свойство коллоидных растворов отличает их от истинных, которые свет не рассеивают.
Частица дисперсной фазы в коллоидном растворе называется мицеллой. Мицелла в целом электронейтральна. В центре мицеллы находится ядро. Ядро мицеллы представляет собой совокупность кристаллически или аморфно упакованных молекул труднорастворимого соединения. Ядро коллоидной частицы прочно адсорбирует на своей поверхности ионы определенного заряда электролита-стабилизатора, которые называются потенциалопределяющими ионами. Ионы противоположного знака, компенсирующие заряд частицы, называются противоионами. Одна часть противоионов располагается за счет электростатического взаимодействия в адсорбционном слое в непосредственной близости к ядру и удерживается частицей при ее передвижении по раствору, а вторая часть противоионов находится в диффузном слое и слабо связана с частицей. Ядро вместе с адсорбционным слоем (потенциалопределяющие ионы совместно с частью противоионов) называется гранулой. Гранула имеет заряд. Знак заряда гранулы определяется потенциалопределяющими ионами, прочно адсорбированными на поверхности ядра коллоидной частицы. Мицелла в целом электронейтральна за счет диффузного слоя.
В качестве примера рассмотрим строение мицеллы иодида серебра в избытке KI.
адсорбционный диффузный
 слой слой
слой слой
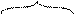
{m[АgI] nI -(n-х)K +}-х xK+

ядро потенциал- противоионы
определяющие
ионы
 |
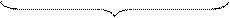 коллоидная частица (гранула)
коллоидная частица (гранула)
мицелла
Коллоидная частица имеет отрицательный заряд, поэтому гранула при электрофорезе будет двигаться к аноду.
Коллоидные растворы на практике получаются двумя способами: а) дроблением более крупных частиц до коллоидных размеров (дисперсионный метод); б) соединением мелких частиц в более крупные до коллоидных размеров (конденсационный метод). Высокая степень дисперсности вещества в коллоидных растворах ведет к увеличению общей суммарной поверхности частиц и обуславливает легкопротекающие процессы адсорбции на их поверхности. Коллоидные частицы адсорбируют на своей поверхности катионы и анионы, приобретая таким способом одноименный электрический заряд, противодействующий их соединению в более крупные агрегаты. Находясь во взвешенном состоянии, частицы распределяются в дисперсионной среде, образуя коллоидный раствор.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!