
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. Учебно-методическое пособие по решению задач
|
|
|
|
Учебно-методическое пособие по решению задач
Анализа
Химические методы
раздела дисциплины «Аналитическая химия
и физико-химические методы анализа»
для студентов-заочников
химико-технологических специальностей
Минск 2003
УДК 543
Рассмотрены и рекомендованы к изданию редакционно-издательским советом университета.
Составители: А. Е. Соколовский, Г. Н. Супиченко
Научный редактор канд. хим. наук,
доцент Е. В. Радион
Рецензенты: доцент кафедры
общей и неорганической химии БГТУ, канд. хим. наук Т. Л. Залевская;
доцент кафедры аналитической химии БГУ, Н. А. Апостол
По тематическому плану изданий учебно-методической литературы университета на 2003 год. Поз. 65.
Для студентов-заочников химико-технологических специальностей.
© Учреждение образования
«Белорусский государственный
технологический университет», 2003
© Соколовский А. Е., Супиченко Г. Н.,
составление, 2003
Настоящее методическое пособие разработано с целью оказания помощи студентам заочного факультета при решении задач контрольных заданий № 1 и № 2 по аналитической химии [1].
В нем даны примеры решения задач из основных разделов контрольных работ. При выборе примеров мы руководствовались опытом проверки заданий. Особое внимание уделяется задачам, в решении которых наиболее часто встречаются ошибки, и задачам, примеры решения которых редко встречаются в рекомендованной литературе. Напротив, примеры решения тех задач, с которыми студенты практически всегда справляются без ошибок, мы не приводим. В частности, задачи по статистической обработке результатов анализа подробно описаны в методическом пособии [2].
При разборе типовых задач даются краткие пояснения теоретического характера, основные формулы, общие алгоритмы и ход решения. Дать решения задач всех типов, встречающихся в контрольных работах, невозможно. Однако в приведенных примерах содержатся основные элементы решения практически любой задачи.
Значения физико-химических констант, используемых в методическом пособии, взяты по справочнику [3]. Им же мы рекомендуем пользоваться при выполнении контрольных заданий.
Контрольная работа № 1
1. РАВНОВЕСИЕ В СИСТЕМЕ ОСАДОК – РАСТВОР
Гетерогенная (неоднородная) система состоит из двух фаз: насыщенного раствора электролита и осадка. В этой системе устанавливается динамическое равновесие:
BaSO4↓ D Ва2+ + 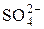
К этой равновесной системе применим закон действия масс, исходя из которого можно сформулировать правило произведения растворимости (ПР): произведение концентраций ионов труднорастворимого электролита в его насыщенном растворе есть величина постоянная при данной температуре:
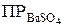 = [Ва2+] · [
= [Ва2+] · [ 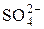 ]
]
Если в формуле имеются стехиометрические коэффициенты, то они входят в уравнение как показатели степени, в которые необходимо возвести концентрации ионов, например:
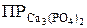 = [Са2+]3 ∙
= [Са2+]3 ∙ 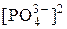
Произведение растворимости характеризует растворимость вещества: чем больше значение ПР, тем больше растворимость.
При более точных расчетах необходимо вместо концентраций ионов использовать значения активностей, учитывающих электростатические взаимодействия между ионами.
Активности ионов пропорциональны концентрациям:
а = f ∙ С
Здесь f = а/С – коэффициент активности, зависящий от концентраций и зарядов всех ионов в растворе, а также от собственного заряда иона. Для нахождения коэффициентов активности сначала рассчитывают ионную силу раствора I по формуле
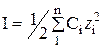
Здесь Сi и z i – молярные концентрации и заряды всех ионов в растворе.
Значение коэффициента активности fi данного иона можно вычислить по уравнению Дебая и Хюккеля:
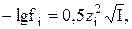 если I < 0,01;
если I < 0,01;
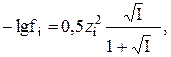 если I < 0,1,
если I < 0,1,
или по формуле Дэвиса:
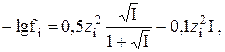 если I < 0,2.
если I < 0,2.
Обычно при решении задач значения коэффициентов активности не рассчитываются. Соответствующие расчеты выполняются, если необходимость их проведения указывается или подразумевается в условии задачи (подраздел 1.1.5 методических указаний [1]).
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 620; Нарушение авторских прав?; Мы поможем в написании вашей работы!