
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
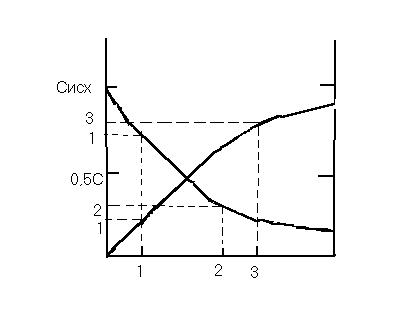
Влияние концентрации на скорость реакции
|
|
|
|
Ni – количество i – го исходного вещества.
Если V=const во время реакции: 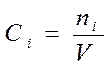
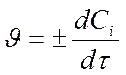
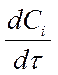 - для исходных веществ - отрицательна Þ
- для исходных веществ - отрицательна Þ 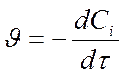
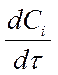 - для продуктов – положительная Þ
- для продуктов – положительная Þ 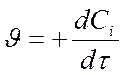
Cкорость реакции зависит от:
1) природы реагирующих веществ,
2) концентрации или давления реагирующих веществ,
3) температуры
4) катализатора
По теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для протекания реакции: A + B→ K + L необходимо:
· одновременное нахождение А и В в определённой точке реакционного пространства;
· удачное их столкновение
Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации:
ω A = α×Cа A, ω B = β×C в B.
Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения:
ω = ω A × ω B = α×Cа A × β×Cв B.
γ – доля удачных столкновений

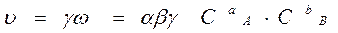

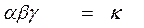
 |

 - основное кинетическое уравнение, закон действия масс, закон Гульдберга Вааге (1864г).
- основное кинетическое уравнение, закон действия масс, закон Гульдберга Вааге (1864г).

k -константа скорости: а) не зависит от концентрации
б) зависит от температуры и природы реагирующих веществ.
k – удельная скорость Þ 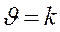 , если СА = С В = 1моль/л
, если СА = С В = 1моль/л
а,в – частные порядки реакции по веществам А и В
(определяются экспериментально)
n = (а + в) – общий порядок реакции
В простых (элементарных актах) реакциях: n = 1, 2 редко 3.
В сложных реакциях: n = 0, целочисленные, дробные, (-),(+)
Молекулярность:
|
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 465; Нарушение авторских прав?; Мы поможем в написании вашей работы!