
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулы комплекс реакции
|
|
|
|
Исходные активированный продукты
К – константа равновесия
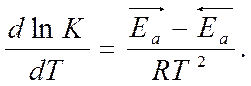
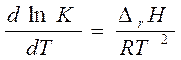 - изобара Вант-Гоффа
- изобара Вант-Гоффа
 Þ связь термодинамических и кинетических параметров
Þ связь термодинамических и кинетических параметров
 |
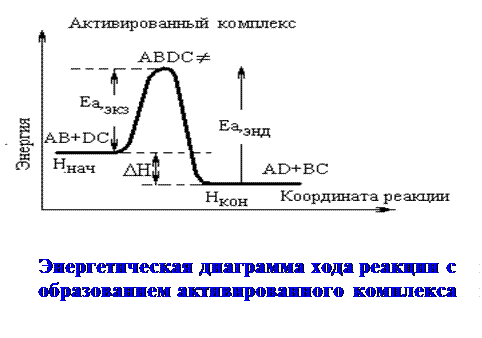
Для образования активированного комплекса необходима энергия Е а:
|
Если ΔrHпрямой реакции > 0 Þ  Þ
Þ
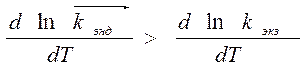
 Þ k эндотерм. с температурой быстрее k экзотерм реакции.
Þ k эндотерм. с температурой быстрее k экзотерм реакции.


Положительный катализ – процесс, ускоряющий реакцию
Отрицательный катализ – процесс, замедляющий реакцию
Kt – ингибиторы (Сl- - ингибитор коррозии)
Антидетонатор Pb(C2H5)4 – замедляет взрывную реакцию топлива
Автокатализ – kt - один из продуктов реакции
FeO + H2 = Fe + H2O Fe - kt
 |
 H2O2 HI-kt H2O + 1/2O2 (H+, OH- -самые активные kt)
H2O2 HI-kt H2O + 1/2O2 (H+, OH- -самые активные kt)

 H2O2 Pt-kt H2O + 1/2O2
H2O2 Pt-kt H2O + 1/2O2
 |
Ферменты являются полимерами (белками) или комплексами полимеров с низкомолекулярными соединениями. Размеры их превышают размеры ионов и молекул в растворах, поэтому ферменты иногда называют микрогетерогенными катализаторами.
Механизм их действия включает образование комплекса активный центр фермента - реагент по типу «замок-ключ».
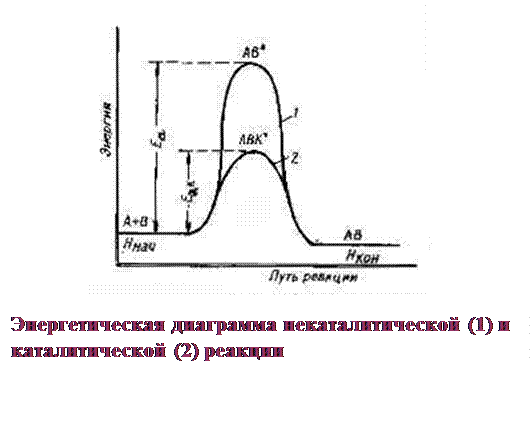 |
Особенности kt:
■ kt – участвует в образовании промежуточных нестойких соединений, а в конце выделяется в химически неизменном виде.
■ S(ЕI а + EII а) промежуточных стадий < Е а неkt реакции


 k =Z×e-Ea/RT×eSa/R Þ скорость, если а) Е а
k =Z×e-Ea/RT×eSa/R Þ скорость, если а) Е а
б) Sа- промежуточное соединение- более «рыхлое»- менее упорядоченное- значит более активное.
■ небольшие количества kt - резко ускоряют процесс
 ■ избирательность kt: Al2O3 С2Н4 + Н2О
■ избирательность kt: Al2O3 С2Н4 + Н2О

 С2Н5ОН H3PO4 С2Н5ОС2Н5+ Н2О
С2Н5ОН H3PO4 С2Н5ОС2Н5+ Н2О
MgO СН3СНО + Н2
■ kt – не изменяют DrН и DrG: DrG 0неkt = DrG 0kt
DrG0 = - RTlnKp Þ не влияет на равновесие, только ускоряет его достижение, т.к. в одинаковое число раз изменяет как J прямой р-ции так и J обр.р-ции (К =kпрям /kобр)

Гомогенный катализ:
1. скорость прямо пропорционально зависит от конц.kt;
2. дешевые, доступные;
3. остаются в реакционной среде – надо выделять – плохо
Гетерогенный катализ
◘ Действие kt зависит от способа получения kt:

 акт Cu(NO3)2 to Cu + 2NO2 + O2
акт Cu(NO3)2 to Cu + 2NO2 + O2
 Cu-kt
Cu-kt
 неакт. Cu(NO3)2 электролиз Cu + O2 +HNO3
неакт. Cu(NO3)2 электролиз Cu + O2 +HNO3
 ◘ присутствия других веществ: активаторы - активность kt
◘ присутствия других веществ: активаторы - активность kt
K2O, Al2O3 – для Fe – kt: N2 + 3H2 = 2NH3
 каталит.яды - активность kt
каталит.яды - активность kt
H2S, C2H2, O2 – для Pt-kt: 2SO2 + O2 = 2SO3
◘ уменьшение поверхности kt – надо чистить Þудорожание

1. Задача. За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3. Скорость образования какого из веществ больше?
Решение. Найдем количество вещества (ν) в молях каждого из продуктов реакции
 |
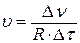
В соответствии с формулой
где R – реакционное пространство, D ν – изменение количества вещества за время D τ; получаем, что скорость образования NН3 больше, чем скорости образования Н2S и СО2.
2. Задача. Во сколько раз изменится скорость реакции
2СО(г) + О2(г) ® 2СО2(г)
при увеличении давления в системе в 10 раз? Температура системы поддерживается постоянной.
Решение. Предположим, что рассматриваемая реакция является элементарной, т. е. для нее справедлив закон действующих масс:
υ = k×с2 (СО)× с (О2).
Учитывая, что концентрация и парциальное давление связаны прямо пропорциональной зависимостью
р i = с i× RT,
получим, что υ= k×р2 (СО)× р (О2).
 |
После увеличения давления в системе в 10 раз парциальное давление каждого из реагентов возрастет тоже в 10 раз, т. е.
Отсюда υ¢/υ = 1000. Следовательно, скорость реакции увеличится в 1000 раз.
3. Задача. В реакции А ® В + С с общим порядком, равным единице, константа скорости k 1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0,2 моль/л.
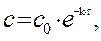 |
Решение. Для реакции 1-го порядка справедливо уравнение
где с – текущая концентрация вещества в момент времени τ, с 0 – начальная концентрация, k – константа скорости, τ – время.
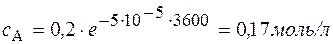
Через 1 час
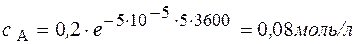
Через 5 часов
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В.

Поэтому через 1 час

Через 5 часов 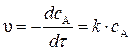
Рассчитаем скорость реакции по уравнению:
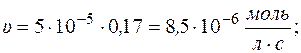
Через 1 час
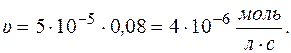
Через 5 часов
4. Задача. Для реакции первого порядка А ® 2В определите время, за которое
прореагирует 90 % вещества А. Константа скорости реакции k 1 = 10-4 с-1.
Решение. После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. 0,1 с 0.


Из уравнения получим, что
Следовательно, τ = ln 10/k1 = 23026 с = 6,4 ч.
5. Задача. При изучении кинетики термического разложения ацетона, являющегося реакцией первого порядка, в соответствии с уравнением:
СН3СОСН3(г) ® С2Н4(г) + СО(г) + Н2(г)
получены следующие экспериментальные данные при Т = 802 К: давление
в реакторе изменилось от начального р 0 = 312 мм. рт. ст. до 408 мм. рт. ст.
за 390 с. Рассчитайте константу скорости реакции.
Решение. Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью
p i =c i ×R×T
или
Отсюда, для реакции I-го порядка
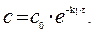
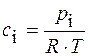 |
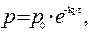
и
Если р0 – это начальное давление ацетона в реакционном сосуде, то для решения задачи необходимо определить парциальное давление этого вещества к моменту времени, когда общее давление
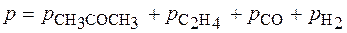 составило 408 мм. рт. ст.
составило 408 мм. рт. ст.
Из стехиометрии реакции видно, что 1 моль ацетона, распадаясь, образует 3 моль газа. Из закона Авогадро следует, что при уменьшении парциального давления ацетона на D р сумма парциальных давлений образовавшихся газов составит 3D р. Таким образом, можно записать
P = p 0 – D p + 3× D p
или
408 = 312 + 2× D p, D p = 48 мм рт.ст.
Следовательно, парциальное давление ацетона через 390 с после начала опыта составило 312 – 48 = 264 (мм. рт. ст.).
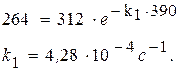 |
После подстановки в уравнение получим:
6. Задача. При температуре 100°С константа скорости реакции второго порядка
2НI(г) ® Н2(г) + I2(г)
равна 8,83×10-16 л/(моль×с). Определите время полупревращения йодистого
водорода, если начальная концентрация его равна 1 моль/л.
Решение. Воспользуемся уравнением для реакции второго порядка:

 |
Далее рассчитаем
7. В реакции второго порядка А + В ® D за 1 час концентрации веществ А и В уменьшились по сравнению с начальной с0 А = с0 В = 0,2 моль/л на 30 %. Определите константу скорости и скорость реакции в начальный момент времени и через час после начала реакции.
Решение. Концентрации веществ А и В за 1 час уменьшились на
0,3× с 0 = 0,06 моль/л. Отсюда, через час концентрации составят
с А = с В = 0,2 – 0,06 = 0,14 (моль/л).
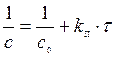
Для реакции II-го порядка
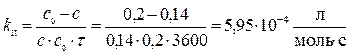
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!