
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунок теплових ефектів хемічних реакцій за теплом утворення сполук
|
|
|
|
РОЗРАХУНОК ТЕПЛОВИХ ЕФЕКТІВ
1. Термохемія дозволяє зробити розрахунок теплових ефектів процесів – хемічних реакцій, розчинення, випаровування, перегону, кристалізації тощо.
2. Розрахунок теплових ефектів хемічних реакцій на основі закону Гесса проводять за теплом утворення і теплом згоряння сполук.
3. Теплом утворення називають тепловий ефект хемічної реакції утворення даної сполуки з простих речовин (1 моля сполуки як одиниці кількости речовини): ΔHf.
4. При цьому тепло утворення простих речовин (N2, Н2, О2) приймають таким, що дорівнює нулю.
5. У зв’язку з тим, що тепловий ефект хемічних реакцій залежить від умов проведення (T, p), прості речовини розглядаються в тому аґреґатному стані і у тій модифікації, в яких вони є стабільними при стандартних (нормованих) умовах: певна модифікація, Tº, рº.
6. Тепло утворення, що розраховане для стандартних умов носить назву стандартного (нормованого).
Наприклад, стандартним теплом утворення карбонату кальцію є тепловий ефект реакції:
Са (т) + С (т) +  О2 (ґ) = СаСО3 (т),
О2 (ґ) = СаСО3 (т),  = − 1206 кДж. (5.23)
= − 1206 кДж. (5.23)
(метал) (ґрафіт) (кристали)
Тут 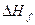 − тепло утворення СаСО3 (т).
− тепло утворення СаСО3 (т).
Такі хемічні реакції переважно практично нездійснені, але їх теплові ефекти застосовують як допоміжні при розрахунках величин тепла утворення інших речовин. Тепло утворення можна віднести до будь-якої кількости речовини (моль, кг, м3).
7. Необхідно розрізняти тепло утворення сполуки з простих речовин від атомарного тепла утворення сполуки. Утворення молекул з вільних атомів завжди супроводжується виділенням енергії.
При утворенні сполук з простих речовин енергія у формі тепла може виділятися або поглинатися, так як утворення вільних атомів з простих речовин вимагає витрат енергії.
Наприклад, утворення ацетилену з атомів вуглецю і водню супроводжується виділенням енергії у формі тепла:
2С (т) + 2Н (ґ) = С2Н2 (ґ),  = − 1648 кДж. (5.24)
= − 1648 кДж. (5.24)
(атом вуглецю) (атом водню)
Утворення ацетилену з ґрафіту і молекули водню супроводжується поглинанням енергії у формі тепла:
2С (т) + Н2 (ґ) = С2Н2 (ґ),  = +227 кДж. (5.25)
= +227 кДж. (5.25)
(ґрафіт) (молекула водню)
Так як розклад молекули водню на атоми вимагає витрат енергії +437 кДж/моль, а для отримання вільних атомів вуглецю з ґрафіту необхідно витратити +719 кДж/г-атом = +719 кДж/моль, то утворення вільних атомів вуглецю і водню в кількости, що необхідна для утворення 1 моля ацетилену, вимагає:
(+437) + 2·(+719) = + 1875 кДж. (5.26)
Різниця між + 1875 – 1648 = +227 кДж відповідає (5.25).
8. Порівняно за невеликим числом стандартного тепла утворення сполук можна розрахувати теплові ефекти більшости хемічних реакцій.
Із закону Гесса витікає, що тепловий ефект хемічної реакції дорівнює різниці між сумою тепла утворення продуктів реакції та сумою тепла утворення вихідних речовин:
 ́, (5.27)
́, (5.27)
де 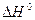 – стандартний тепловий ефект хемічної реакції;
– стандартний тепловий ефект хемічної реакції;
 – сума тепла утворення продуктів хемічної реакції;
– сума тепла утворення продуктів хемічної реакції;
 – сума тепла утворення вихідних речовин (f – від formation – утворення);
– сума тепла утворення вихідних речовин (f – від formation – утворення);

 ,
,  − стехіометричні коефіцієнти продуктів реакції і вихідних речовин відповідно у рівнянні хемічної реакції.
− стехіометричні коефіцієнти продуктів реакції і вихідних речовин відповідно у рівнянні хемічної реакції.
Так, для довільної хемічної реакції
bB + dD = gG + rR, (5.28)
де B, D − вихідні речовини;
G, R − продукти хемічної реакції;
b, d, g, r − стехіометричні коефіцієнти вихідних речовин і продуктів хемічної реакції.
Якщо 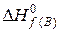 ,
,  ,
, 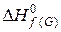 ,
,  − тепло утворення вихідних речовин і продуктів реакції відповідно, то тепловий ефект хемічної реакції при температурі Тº:
− тепло утворення вихідних речовин і продуктів реакції відповідно, то тепловий ефект хемічної реакції при температурі Тº:
ΔНº = [g 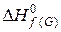 +r
+r  ] − [b
] − [b 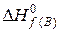 + d
+ d  ]. (5.29)
]. (5.29)
Наприклад, отримання при 25 ºС Al2(SО4)3 з кристалічного Аl2О3 (т) і ґазу SО3 за реакцією:
Аl2О3 (т) + 3SО3 (ґ) = Аl2(SО4)3 (т), (5.30)
виходячи з тепла утворення
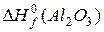 = − 1672 кДж/моль;
= − 1672 кДж/моль;
 = − 396 кДж/моль;
= − 396 кДж/моль;
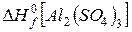 = − 3440 кДж/моль,
= − 3440 кДж/моль,
тепловий ефект хемічної реакції (5.30):
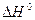 =
=  −[
−[ 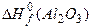 +3
+3  ]=−3440−[(−1672)+(−3·396)]= = − 580 кДж. (5.31)
]=−3440−[(−1672)+(−3·396)]= = − 580 кДж. (5.31)
Схема термохемічних розрахунків (рис. 5.3) хемічної реакції
Аl2О3 (т) + 3SО3 (ґ) = Аl2(SО4)3 (т), 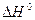 = − 580 кДж. (5.32)
= − 580 кДж. (5.32)
 |
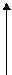 Al2O3 Al2O3
|  3SO3 3SO3
|


 Al2(SO4)3 Al2(SO4)3
|
| 2Al | 3S | 6O2 |
Рис. 5.3. Схема розрахунку теплового ефекту хемічної реакції (5.30)
9. Стандартне тепло утворення (ентальпія) сполуки є важливою енергетичною характеристикою її стійкости:
· якщо 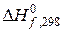 < 0, то речовина є стійкішою, ніж прості (вихідні) речовини, з яких вона утворилася;
< 0, то речовина є стійкішою, ніж прості (вихідні) речовини, з яких вона утворилася;
· якщо 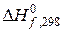 > 0, то речовина є менш стійкою, ніж прості (вихідні) речовин, з яких вона утворилася;
> 0, то речовина є менш стійкою, ніж прості (вихідні) речовин, з яких вона утворилася;
· наприклад, у ряду сполук
ZnO, CdO, HgO стандартне тепло їх утворення дорівнює
 –350; –260; +90,9 (відповідно), і в такій послідовности зменшується стійкість цих сполук.
–350; –260; +90,9 (відповідно), і в такій послідовности зменшується стійкість цих сполук.
5.3.2. Тепловий ефект утворення сполуки певного аґреґатного стану (тепло аґреґатного стану)
Тепловий ефект утворення сполуки певного аґреґатного стану дорівнює:
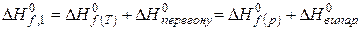 , (5.33)
, (5.33)
де 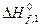 − тепловий ефект утворення хемічної сполуки в іншому аґреґатному стані;
− тепловий ефект утворення хемічної сполуки в іншому аґреґатному стані;
 − тепловий ефект утворення хемічної сполуки у твердому стані;
− тепловий ефект утворення хемічної сполуки у твердому стані;
 − тепловий ефект утворення хемічної сполуки у рідкому стані;
− тепловий ефект утворення хемічної сполуки у рідкому стані;
 ,
, 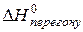 ,
,  − тепло топлення, перегону, випаровування одного моля хемічної сполуки, які пов’язані співвідношенням:
− тепло топлення, перегону, випаровування одного моля хемічної сполуки, які пов’язані співвідношенням:
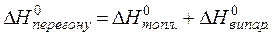 (5.34)
(5.34)
5.3.3. Тепловий ефект утворення сполуки у розчині (тепло розчинення)
1. При термохемічних розрахунках хемічних реакцій в розчинах необхідно враховувати тепловий ефект процесу розчинення сполуки в даному розчиннику.
2. Тепловий ефект утворення хемічної сполуки в розчині, яка дисоціює на іони, визначається за теплом утворення йонів у розчині.
Наприклад:
а) тепло утворення іону 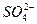 уявляє собою тепловий ефект хемічної реакції:
уявляє собою тепловий ефект хемічної реакції:
 (ґ)+
(ґ)+  ,
,  , (5.35)
, (5.35)
де aq. (від лат. «aqua» − вода) означає, що реакція проводиться в розчині;
б) тепло утворення іону гідроксонію  за реакцією:
за реакцією:
 (5.36)
(5.36)
уявляє собою тепловий ефект реакції в термінах термохемічного рівняння:
 ,
,  , (5.37)
, (5.37)
де  .
.
3. Згідно закону Гесса тепло утворення речовини в розчині дорівнює його теплу утворення плюс тепло розчинення:
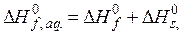 (s – від solution – розчинення). (5.38)
(s – від solution – розчинення). (5.38)
4. Інтеґральним теплом розчинення називають тепло, яке поглинається або виділяється при розчиненні 1 моля сполуки в такій кількости розчинника, щоб утворився розчин з певною моляльністю m.
5. Тепло розчинення твердої сполуки з іонною кристалічною ґраткою дорівнює сумі тепла руйнування кристалічної ґратки та тепла сольватації іонів молекулами розчинника.
6. Тепло руйнування кристалічної ґратки має знак «+» (тепло поглинається), а процес сольватації супроводжується виділенням тепла (знак «−»). Тоді, знак тепла розчинення може бути «+» або «−», наприклад, при розчиненні 1 моля кристалогідрату  у воді тепло розчинення дорівнює:
у воді тепло розчинення дорівнює:
8 молей води 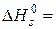 +3,35 кДж;
+3,35 кДж;
12 молей води 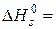 0;
0;
∞ молей води 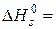 −17,67 кДж.
−17,67 кДж.
Тепло розчинення залежить від концентрації хемічної сполуки в розчині (рис. 5.4).
 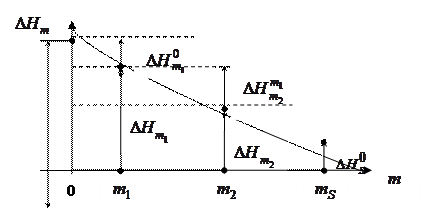 |
Рис. 5.4. Залежність інтеґрального тепла розчинення ΔНm від моляльної концентрації розчину
На рис. 5.4 показано залежність інтеґрального тепла розчинення ΔНm від моляльности m розчину. Тут:
 − перше інтеґральне тепло розчинення, яке дорівнює тепловому ефекту при розчиненні 1 моля речовини у безкінечно великій (∞) кількости розчинника (m→0) і визначається екстраполяцією кривої ΔН ~ f (m) до m=0;
− перше інтеґральне тепло розчинення, яке дорівнює тепловому ефекту при розчиненні 1 моля речовини у безкінечно великій (∞) кількости розчинника (m→0) і визначається екстраполяцією кривої ΔН ~ f (m) до m=0;
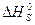 − повне інтеґральне тепло розчинення, яке дорівнює тепловому ефекту при розчиненні 1 моля речовини в такій кількости розчинника, щоб утворився насичений розчин.
− повне інтеґральне тепло розчинення, яке дорівнює тепловому ефекту при розчиненні 1 моля речовини в такій кількости розчинника, щоб утворився насичений розчин.
Наприклад, користуючись інтеґральним теплом розчинення, розрахувати тепло утворення кристалогідрату CuSO4·5H2O з CuSO4(т) і Н2О(р) при стандартних умовах.
Розглянемо процеси, що здійснюються двома шляхами:
· CuSO4(т) + 5Н2О(р) = CuSO4·5H2O(т), ΔН0 (5.39)
CuSO4·5H2O(т) + 795H2O(р) = CuSO4·aq,  (5.40)
(5.40)
· CuSO4(т) + 800Н2О(р) = CuSO4·aq,  (5.41)
(5.41)
За законом Гесса запишемо:
ΔН0 + 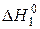 =
= 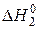 , (5.42)
, (5.42)
звідки ΔН0 = 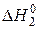 –
– 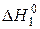 , (5.43)
, (5.43)
де 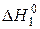 – інтеґральне тепло розчинення кристалогідрату CuSO4·5H2O(т) у воді;
– інтеґральне тепло розчинення кристалогідрату CuSO4·5H2O(т) у воді;
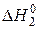 – інтеґральне тепло розчинення безводної солі CuSO4(т) у воді.
– інтеґральне тепло розчинення безводної солі CuSO4(т) у воді.
Розрахунок тепла утворення кристалогідрату CuSO4·5H2O(т):
ΔН0 = –66,53 – 11,72 = –78,25 кДж/моль, (5.44)
тобто утворення кристалогідрату йде із значним виділенням тепла.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 744; Нарушение авторских прав?; Мы поможем в написании вашей работы!