
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярно-кінетична теорія. Закон Дюлонґа і Пті
|
|
|
|
Теорії теплоємностей твердих тіл
За класичною молекулярно-кінетичною теорією розрахунки теплоємности ґрунтуються на законі рівномірного розподілу енергії за ступенями вільностей коливань атомів у вузлах ґратки ідеального кристалу елементу.

 Кристалу, що складається з N атомів, приписують 3N коливальних ступенів вільностей атомів вузлів кристалічної ґратки, на кожну з яких припадає енергія kТ, де k – константа Больцмана.
Кристалу, що складається з N атомів, приписують 3N коливальних ступенів вільностей атомів вузлів кристалічної ґратки, на кожну з яких припадає енергія kТ, де k – константа Больцмана.
Всього атом кристалу елементу має z=3 коливальних ступенів вільностей і атомність його N=1, тоді z·N=3 коливальних ступенів вільностей. Звідки
 dUμ = 3·NA·kdT, (4.54)
dUμ = 3·NA·kdT, (4.54)
 тоді (за новими даними NA i k):
тоді (за новими даними NA i k):

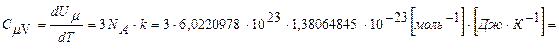
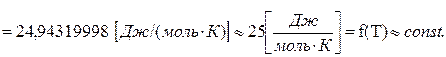
З іншого боку dUμ=3RμdT. Експериментально, а потім методами молекулярно-кінетичної теорії доведено, що при середніх і високих температурах (вище кімнатних) масова теплоємність твердого тіла дорівнює приблизно:
CV=3R≈const (4.55)
Відповідно мольна теплоємність буде дорівнювати
μСv = μ3R, звідки
CμV =3Rμ= 3·8,3144±0,0026≈24,9432±0,0078≈25  . (4.56)
. (4.56)
На відміну від хемічних сполук, хемічні елементи у твердій фазі знаходяться в атомарному стані, навіть у тих випадках, коли в ґазовій фазі атоми даного елементу утворюють молекулу, наприклад Н2, N2, тому при розрахунках CμV величину Rμ необхідно ділити не на молекулярну, а на атомну масу. На кожну ступінь вільностей коливального руху (потенціальної та коливальної частин) атомів кристалу елемента у ізохорній мольній теплоємности припадає величина, яка чисельно дорівнює універсальній газовій сталій Rμ.
Закон Дюлонґа і Пті (1819р.): при кімнатних температурах для елементів з атомною масою, що більша за атомну масу калію, добуток теплоємности на атомну масу є величина стала.
Зауваги до означених співвідношень:
1) у дійсности CμV(Т)=const це є лише границя, до якої прагне теплоємність речовини

 ; (4.57)
; (4.57)
2) ці значення теплоємностей кристалів елементів добре узгоджуються з експериментальними даними для багатьох твердих тіл від кімнатних до достатньо високих температур, але закон носить наближений характер;
3) закон Дюлонґа і Пті виконується для деяких речовин з атомністю
N = 1, 2, 3, наприклад:
N = 1 Me
N = 2 NaCl
N = 3 PbCl2;
4) закон Дюлонґа і Пті не працює для твердих тіл, в яких відбуваються фазові перетворення: перехід з однієї кристалічної модифікації в іншу, з феромаґнетика у парамаґнетик, із напівпровідника у звичайний провідник тощо. У точках фазових переходів теплоємність і коефіцієнт термічного розширення проходять через гострий максимум;
5) для деяких простих речовин (елементів, наприклад для алмазу і бору) і складних речовин спостерігається значне відхилення від закону Дюлонґа і Пті при кімнатних і високих температурах (CμV≈7,33 та 11,73 Дж/(моль·К) для алмазу та бору відповідно);
6) закон не враховує залежність теплоємности від температури;
7) при низьких температурах теплоємности твердих тіл мають значно менші значення, ніж 25 Дж/(моль·К), а при Т→ 0К закон Дюлонґа і Пті перестає працювати, особливо при Т≤θ, де θ − характеристична температура Дебая:

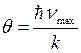 , (4.58)
, (4.58)
де νmax − максимально можлива частота власних коливань атомів (йонів) твердого тіла.
Відхилення від закону тим суттєві, чим ближче Т до Т0 = 0К. Характеристичні температури Дебая θ [K] для більшости елементів лежать в межах 100−400К (для Ве θ = 1160К, для алмазу θ = 1860 (1850)К, а для молекулярних кристалів θ ≈ 10К − це аномально низькі величини).
8) закон Дюлонґа і Пті не враховує електронну теплоємність, що пов'язана з рухом вільних електронів, так що сумарна теплоємність твердих тіл складається із коливальної та електронної складових:
С = СК (Т3) + Се (Т). (4.59)
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!