
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса
|
|
|
|
Формулювання закону Гесса:
- Антуан Лавуазьє і П’єр Лаплас (1780 р.): кількість тепла, що поглинається при розкладі сполуки дорівнює кількости тепла, що виділяється при її утворенні при однакових умовах.
- Герман Гесс (1840 р.): сумарний тепловий ефект хемічної реакції при р=const дорівнює ΔН, а при V=const – ΔU і залежить від начального і кінцевого стану системи, і не залежить від проміжних стадій і шляхів переходу.
- Закон Гесса у сучасному означенні: тепловий ефект хемічної реакції залежить від природи і стану вихідних речовин і кінцевих продуктів реакції і не залежить від шляху переходу між ними.
- Всі три формулювання витікають з першого начала термодинаміки і є вислідом того, що Н і U є функціями термодинамічного стану.
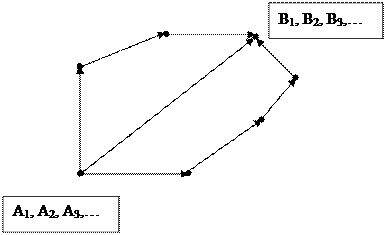
- Загальна схема пояснення закону Гесса приведена на рис. 5.1.
 |
4 Q4 2
Q3
3 Q8
Q1
Q2 Q7
Q6
1 Q5 5
Рис. 5.1. Загальна схема до закону Гесса за шляхами переходу системи:
1→3→4→2; 1→2; 1→5→6→7→2.
На рис. 5.1: А1, А2, А3, … – вихідні речовини реакції;
B1, B2, B3, … – кінцеві продукти реакції.
Тоді Q1=Q2+Q3+Q4=Q5+Q6+Q7+Q8. (5.15)
- Приклад 1. Застосування закону Гесса для розрахунку тепла окиснення заліза:
2Fe(т) + 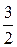 O2(ґ) = Fe2O3(т),
O2(ґ) = Fe2O3(т), 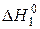 = –821кДж. (5.16)
= –821кДж. (5.16)
Реакція (5.16) може бути здійснена з утворенням проміжних продуктів FeО (ІІ):
2Fe(т) + O2(ґ) = 2FeO(т), 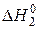 = –527 кДж; (5.17)
= –527 кДж; (5.17)
2FeО(т) + 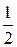 O2(ґ) = Fe2O3(т),
O2(ґ) = Fe2O3(т), 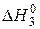 = –294 кДж. (5.18)
= –294 кДж. (5.18)
 2Fe(т) +
2Fe(т) + 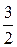 O2(ґ) = Fe2O3(т), (5.19)
O2(ґ) = Fe2O3(т), (5.19)
ΔH01= ΔH02 + ΔH03 = (–527) + (–294) = –821кДж. (5.20)
Приклад 2. Застосування закону Гесса для розрахунку тепла утворення ΔHf (СО) з ґрафіту.
За схемою (рис. 5.2), що ілюструє закон Гесса,ΔHf (СО) можна розрахувати, знаючи, що тепло згоряння СО [ΔHс(СО)] і С [ΔHс(С)] до СО2 при Т=298,15 К дорівнюють відповідно (–282,99) кДж/моль і (–393,32) кДж/моль відповідно. Розглянемо два шляхи утворення СО2: з ґрафіту при безпосередньому згорянні його і при проміжному утворенні СО (рис. 5.2).
За законом Гесса загальний тепловий ефект обох шляхів переходу однаковий, тому знаходимо:
ΔHf (СО) = [ΔHс(С)] – [ΔHс(СО)] = –393,32 – (–282,99) = –110,33кДж.

Рис. 5.2. Шляхи утворення СО2 з ґрафіту
- Обмеження застосування закону Гесса для розрахунку теплових ефектів.
1) Закон є точним лише для процесів V=const (ΔU) і р=const (ΔН).
2) Закон є правдивим, якщо для кількох процесів (шляхів переходу) будуть однакові початкові і кінцеві стани, а саме:
§ однаковий хемічний склад;
§ однакові умови існування (р, Т,…);
§ однакові аґреґатні і фазові стани (між (ґ) і (р) є різниця тепла на випаровування або конденсацію; між (ґ) і (т) є різниця тепла на перегін або деперегін; між (р) і (т) є різниця тепла на топлення або твердіння).
Наприклад:
Н2(ґ) + 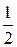 О2(ґ) = Н2О(ґ), ΔН01 = –242 кДж, (5.21)
О2(ґ) = Н2О(ґ), ΔН01 = –242 кДж, (5.21)
Н2(ґ) + 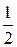 О2(ґ) = Н2О(р), ΔН02 = –286 кДж, (5.22)
О2(ґ) = Н2О(р), ΔН02 = –286 кДж, (5.22)
Різниця на випаровування:
ΔН02 – ΔН01 = –(286– 242)=Qвипар.= –44 кДж.
§ для кристалічних тіл – однакова кристалічна модифікація;
§ для високодисперсних тіл – однакова ступінь дисперсности;
§ однаковий чистий вигляд в твердому стані чи в розчині.
|
|
|
|
|
Дата добавления: 2014-12-25; Просмотров: 715; Нарушение авторских прав?; Мы поможем в написании вашей работы!