
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые осадительного титрования
|
|
|
|
Требования, предъявляемые к реакциям в методе осадительного титрования
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ
Осадительное титрование – методы титриметрического анализа, основанные на применении титрантов, образующих с титруемым веществом мало растворимое соединение.
1. Определяемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и содержать ион, который вступает в реакцию осаждения с титрантом.
2. Реакция осаждения должна протекать строго стехиометрически.
3. Реакция должна протекать практически до конца. Метод следует применять только тогда, когда произведение растворимости образующегося осадка МА ПР< 10 – 8 и для осадков МА2 и М2А ПР< 10 – 12 (где М – катион металла, А –анион).
4. Осадок должен выпадать быстро при комнатной температуре. Пересыщенные растворы образовываться не должны.
Классификация методов осадительного титрования
Методы осадительного титрования классифицируют по природе активного реагента, взаимодействующего с определяемым веществом:
1. Аргентометрия (AgNO3);
2. Тиоцианометрия (NH4NCS, KNCS);
3. Меркурометрия (Hg2(NO3)2);
4. Гексацианоферратометрия (K4[Fe(CN)6];
5. Бариметрия (BaCl2).
и другие
Кривые осадительного титрования строят, откладывая по оси абсцисс рМ или рА, а по оси ординат Vt, где рМ = - lg [M], а рА = -lg[A], Vt объём добавленного титранта (иногда вместо Vt применяют f – степень оттитрованности).
Проведём формулы расчёта кривой титрования хлорида натрия нитратом серебра.
1.Исходный раствор рассчитывают по формуле
2. Расчёт до точки эквивалентности.
После начала прибавления титранта и до точки эквивалентности концентрация хлорид-ионов в титруемом растворе уменьшается. Концентрацию рассчитывают по формуле
где
3.Расчёт pCl в точке эквивалентности.
В точке эквивалентности все хлорид-ионы оттитрованы.
Образовалось эквивалентное количество осадка AgCl.
Равновесную концентрацию хлорид-ионов можно рассчитать из ПР.
4.Расчёт pCl после точки эквивалентности.
Дальнейшее прибавление титранта (раствора нитрата серебра) приводит к уменьшению растворимости осадка хлорида серебра из-за влияния вводимых одноименных ионов (катионов серебра). Значение pCl можно рассчитать, зная произведение растворимости хлорида серебра и равновесные концентрации.
Равновесная концентрация ионов серебра определяется
Зная объём прибавленного титранта можно найти [ ] [ ]
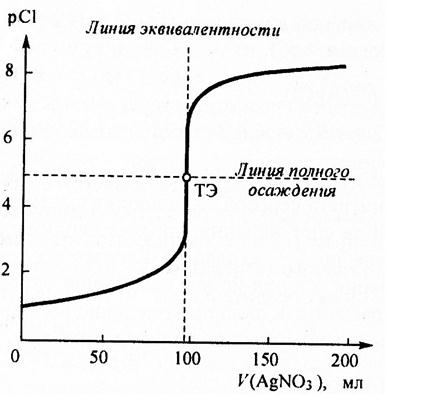
Рис. Рассчитанная кривая осадительного титрования 100 мл 0,1 моль/л раствора хлорида натрия стандартным 0,1 моль/л раствором нитрата серебра
В рассматриваемом случае линии полного осаждения соответствует значение pCl равное 4,875 в точке эквивалентности, а реальная кривая отличается от рассчитанной вследствие допущений при расчёте. Характер кривой однако сохраняется.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 2095; Нарушение авторских прав?; Мы поможем в написании вашей работы!