
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 7. 2 страница
|
|
|
|
Задание 5. Термодинамика химических процессов (по разделам стандарта: химическая термодинамика; энергетика химических процессов)
Рекомендуемая литература: [1], гл. 6; [2], § 5.1-5.4; [3], гл. V, § 1; [4], гл. 5, §§ 1, 2, 12-14; лекции.
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:
1.1. Что изучает химическая термодинамика и ее раздел "термохимия".
1.2. Какие величины являются термодинамическими функциями состояния системы, а какие являются параметрами; каковы обозначения и размерности этих величин.
1.3. Каковы признаки изобарных, изохорных и изотермических процессов; как выражается первый закон термодинамики для изобарных и изохорных процессов.
1.4. В чем состоит сущность термодинамической функции "энтальпия системы", от чего она зависит и почему является функцией состояния.
1.5. Какова взаимосвязь между энтальпией и тепловым эффектом реакции.
1.6. Что называется стандартной энтальпией, энтропией и энергией Гиббса образования сложного вещества (DH0298, S0298, DG0298 соответственно), в каких единицах они выражаются.
1.7. Какие уравнения реакций называются термохимическими; какое значение имеет изменение энтальпии при экзо- и эндотермических реакциях?
1.8. Как формулируются закон Гесса и следствия из него, каково их практическое значение; как они используются при расчете изменения энтальпии, энтропии и энергии Гиббса химических и физико-химических процессов и для определения устойчивости веществ.
1.9. Какова сущность понятия "энтропия системы"; какова взаимосвязь между энтропией и термодинамической вероятностью системы; как изменяется энтропия в системе в случае самопроизвольно протекающих химических или физико-химических процессов при DН=0.
1.10. Что понимается под энтальпийным и энтропийным факторами.
1.11. Каковы сущность понятия "энергия Гиббса" и математическое выражение для ее расчета. Почему энергия Гиббса называется движущей силой процессов; какие по знаку значения D G являются критерием самопроизвольного протекания химических и физико-химических процессов; при каких сочетаниях знаков величин DН и T∙DS процесс всегда возможен, а при каких невозможен.
1.12. Чем характеризуется состояние термодинамического равновесия; каково выражение для расчета температуры, при которой в системе устанавливается термодинамическое равновесие.
2. Письменное задание для контроля усвоения темы:
Для данной в Вашем варианте реакции (табл. 3.18):
2.1. Составьте по закону Гесса и следствию из него общие выражения для расчета изменений энтальпии, энтропии и энергии Гиббса применительно к данной химической реакции при стандартных условиях (DH0х.р., S0х.р., DG0х.р.).
2.2. Рассчитайте значения величин ΔН0, ΔS0, ΔG0 для данной реакции, использовав термодинамические характеристики соответствующих веществ, приведенных в таблице 3.19. Укажите размерности всех рассчитанных величин.
2.3. Охарактеризуйте сущность термодинамических величин Н, S, G и их изменений ΔН, ΔS, ΔG.
2.4. Укажите, каково соотношение между ΔН и Q и каков тепловой эффект данной реакции; к какому термохимическому типу она относится (экзо- или эндотермическая) и почему.
2.5. На основании проведенных расчетов определите, возможно или нет самопроизвольное протекание данной реакции при стандартных условиях в прямом направлении и обоснуйте свой ответ.
2.6. Приведите уравнение для расчета ΔG при различных значениях температуры. Рассчитайте ΔG в данной реакции при 500 К и определите, в прямом или обратном направлении будет проходить данная реакция при этой температуре.
2.7. Охарактеризуйте состояние термодинамического равновесия; каково значение ΔG при его достижении; рассчитайте значение температуры, при которой достигается термодинамическое равновесие (Травн.), и укажите, для чего можно использовать её значение.
2.8. Укажите, какое из подчеркнутых в уравнении данной реакции веществ является более термодинамически устойчивым. Обоснуйте это с приведением соответствующих термодинамических величин и формулировки одного из следствий закона Гесса.
2.9. Укажите, при каких соотношениях и знаках величин DH и Т∙DS самопроизвольное протекание реакции: а) возможно; б) невозможно и обоснуйте свой ответ.
Таблица 3.18
| Ва- ри- ант | Реакция | Ва- ри- ант | Реакция |
| 4 NH3 (г) + 5 О2(г) = 4 NO (г) + 6 H2O(г) | 2 СН3ОН(ж) + 3 О2(г) = 2 СО2(г) + 4 Н2О(ж) | ||
| 2 C2H6 (г) + 7 О2(г) = 4 СО2 (г) + 6 Н2О(г) | NH3(г) + HCl(г) = NH4Cl(к) | ||
| 2 Н2S (г) + 3 О2(г) = 2 SO2 (г) + 2 Н2О(г) | 2 SO2(г) + О2(г) = 2 SO3(г) | ||
| Н2S (г) + I2(г) = 2 НI(г) + S (к) | H2S(г) + О2(г) = 2 Н2О(г) + 2 S(к) | ||
| Fe2O3(к) + 3 H2(г) = 2 Fe(к) + 3 H2O(г) | Li2O(к) + Н2О(ж) = 2 LiOH(к) | ||
| СО(г) + 3 Н2(г) = СН4(г) + Н2О(г) | CuO(к) + 2 НCl(г) = CuCl2(к) + H2O(ж) | ||
| С2Н5ОН (ж) + 3 О2(г) = 2 СО2(г) + 3 Н2О(ж) | Cr2O3(к) + 2 Al(к) = Al2O3(к) + 2 Сr(к) | ||
| 2 С2Н2(г) + 5 О2(г) = 4 СО2(г) + 3 Н2О(г) | NH3(г) + 3 О2(г) = 2 N2(г) + 6 Н2О(ж) | ||
| СО2(г) + 4 Н2(г) = СН4(г) + 2 Н2О (г) | 3 NO2(г) + Н2О(ж) = 2 HNO3(ж) + NO(г) | ||
| СаСО3(к) = СаО(к) + СО2(г) | 2 NO(г) + О2(г) = 2 NO2(г) | ||
| Fe (к) + 2HCI(ж) = FeCI2 (к) + H2(г) | 4 NO2(г) + 2 Н2О(ж) + О2(г) = 4 HNO3(ж) | ||
| СаО(к) + Н2О(ж) = Са(ОН)2(к) | Fe2O3(к) + MnO2(к) + 5 С(к) = 2 Fe(к) + Mn(к) + 5 СО(г) | ||
| 2 СН4(г) = С2Н2(г) + 3 Н2(г) | 2 FeCl2(к) + Cl2(г) = 2 FeCl3(к) | ||
| 2 Н2О2(ж) = 2 Н2О(ж) + О2(г) | Mg(к) + 2 НCl(г) = MgCl2(к) + Н2(г) | ||
| Al2O3(к) + Н2(г) = Al(к) + Н2О(г) | Na2CO3(к) + 2 HCl(г) = 2 NaCl(к) + Н2О(ж) + СО2(г) | ||
| NH4Cl(к) = NH3(г) + HCl(г) | Br2(ж) + H2S(г) = HBr(г) + S(к) | ||
| СН4(г) + СО2(г) = 2 СО(г) + 2 Н2(г) | HCl(г) + NaOH(к) = NaCl(к) + Н2О(г) | ||
| С2Н4(г) + 3 О2(г) = 2 СО2(г) + 2 Н2О(ж) | MgO(к) + Н2(г) = Mg(к) + Н2О(г) |
Таблица 3.19 – Термодинамические характеристики веществ, приведенных в таблице 3.18
| Вещество | 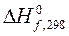 кДж/моль
кДж/моль
| 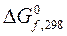 кДж/моль
кДж/моль
| 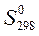 Дж/(моль ·К)
Дж/(моль ·К)
|
| Al (к) | 0,00 | 0,00 | 28,32 |
| Al2O3 (к, корунд) | -1676,0 | -1580,0 | 50,94 |
| Br2 (ж) | 0,00 | 0,00 | 152,3 |
| С (к, графит) | 0,00 | 0,00 | 5,74 |
| СО (г) | -110,5 | -137,14 | 197,54 |
| СО2 (г) | -393,51 | -394,38 | 213,68 |
| СН4 (г) | -74,85 | -50,79 | 186,19 |
| С2Н2 (г) | 226,75 | 209,2 | 200,8 |
| С2Н4 (г) | 52,28 | 68,11 | 219,4 |
| С2Н6 (г) | -84,68 | -32,89 | 229,5 |
| СН3ОН (ж) | -238,6 | -166,23 | 126,8 |
| С2Н5ОН (ж) | -277,7 | -174,76 | 160,7 |
| CaCО3 (к, кальцит) | -1207,1 | -1128,76 | 92,88 |
| CaO (к) | -635,5 | -604,2 | 39,7 |
| Ca(OH)2 (к) | -986,2 | -898,5 | 83,4 |
| Cl2 (г) | 0,00 | 0,00 | 222,96 |
Продолжение таблицы 3.19
| Вещество | 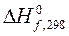 кДж/моль
кДж/моль
| 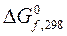 кДж/моль
кДж/моль
| 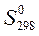 Дж/(моль ·К)
Дж/(моль ·К)
|
| Cr (к) | 0,00 | 0,00 | 23,76 |
| Cr2O3 (к) | -1141 | -1058 | 81,1 |
| CuCl2 (к) | -172,4 | 131,4 | 118,8 |
| CuO (к) | -165,0 | -127,0 | 42,64 |
| Fe (к) | 0,00 | 0,00 | 27,15 |
| FeCl2 (к) | -341,0 | -301,7 | 120,1 |
| FeCl3 (к) | -390,8 | -328,7 | 154,4 |
| Fe2O3 (к) | -822,16 | -740,98 | 89,96 |
| H2 (г) | 0,00 | 0,00 | 130,58 |
| HBr (г) | -35,98 | -53,5 | 198,5 |
| HCl (г) | -92,3 | 95,27 | 186,69 |
| HI (г) | 25,94 | 1,3 | 206,3 |
| HNO3 (ж) | -174,3 | -80,3 | 156,6 |
| H2O (г) | -241,82 | -228,61 | 188,7 |
| H2O (ж) | -285,84 | -237,2 | 70,08 |
| H2O2(ж) | -187,8 | -120,4 | 109,6 |
| H2S (г) | -20,17 | -33,01 | 205,6 |
| I2 (г) | 62,24 | 19,4 | 260,58 |
| LiOH (к) | -487,8 | -443,9 | 42,7 |
| Li2O (к) | -598,7 | -562,1 | 37,9 |
| Mg (к) | 0,00 | 0,00 | 32,55 |
| MgCl2 (к) | -641,6 | -592,1 | 89,6 |
| MgO (к) | -601,24 | -569,4 | 26,94 |
| Mn (к) | 0,00 | 0,00 | 30,02 |
| MnO2 (к) | -519,4 | -464,8 | 53,14 |
| N2 (г) | 0,00 | 0,00 | 191,5 |
| NH3 (г) | -46,19 | -16,66 | 192,5 |
| NH4Cl (к) | -314,4 | -203,0 | 94,6 |
| NO (г) | 90,37 | 86,71 | 210,62 |
| NO2 (г) | 33,50 | 51,8 | 240,45 |
| NaCl (к) | -410,9 | -384,0 | 72,33 |
| NaOH (к) | -427,8 | -381,1 | 64,18 |
| Na2CO3 (к) | -1130,9 | -1047,7 | 136,0 |
| O2 (г) | 0,00 | 0,00 | 205,04 |
| S (к, ромб.) | 0,00 | 0,00 | 31,88 |
| SO2 (г) | -296,9 | -300,4 | 248,1 |
| SO3 (г) | -395,2 | -370,4 | 256,23 |
Комплексное тестовое задание 2 по теме "Химическая термодинамика"
Правильные ответы по п. А приведены в конце пособия в таблице 4.1.
А. Выберите правильный ответ (1, 2 или 3) из задания по Вашему варианту в таблице 3.20 и приведите его.
Б. Обоснуйте ответ по п. А, сопроводив его необходимыми объяснениями. Приведите формулировку закона Гесса, 1-го и 2-го следствий из него. Укажите сущность, математические выражения, размерность термодинамической функции или другого понятия, рассматриваемых в Вашем варианте.
Таблица 3.20 – Тестовое задание 11 (Т-11)
| Ва-ри-ант | Задание | Варианты ответа | ||
| 1. Что изучает термохимия? | тепловые эффекты химических реакций | скорость протекания реакций | степень упорядоченности системы | |
| Как называется величина, обозначаемая DH? | энтропия | изменение энта-льпии | энергия Гиббса | |
| Термохимические расчеты проводятся на основе: | закона Гесса | закона действую-щих масс | закона Ома | |
| Термодинамическая функция, обозначаемая S0, называется: | внутренняя энергия | энтальпия | энтропия | |
| В ходе химической реакции энергия систкмы: | всегда понижается | всегда повышается | может или повышаться, или понижаться | |
| Эндотермической реакцией является: | CaO + H2O = Ca(OH)2, + Q | 2KMnO4 = MnO2 + K2MnO4 + O2, DH0298 > 0 | H2 + Cl2 = 2HCl, DH0298 < 0 | |
| Химическая реакция является экзотермической, если разность между суммой значений энергий связей в исходных веществах и суммой значений энергий связей в продуктах реакции: | больше нуля | меньше нуля | равна нулю | |
| Реакция, протекающая с поглощением тепла, называется: | экзотермической | изотермической | эндотермической |
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
| Ва-ри-ант | Задание | Варианты ответа | ||
| Реакция, протекающая по уравнению 3H2 + N2 = 2NH3; -DH, является: | обратимой экзотермической | необратимой экзотермической | обратимой эндотермической | |
| Реакция, уравнение которой 2H2O + 2Na ® 2NaOH + H2, -DH, относится: | к экзотермическим реакциям замещения | к экзотермическим реакциям присоединения | к эндотермическим реакциям замещения | |
| Стандартные значения энтальпии образования простых веществ: | больше нуля | равны нулю | меньше нуля | |
| Степень упорядоченности системы характеризует величина, называемая: | энтальпией | энтропией | энергией Гиббса | |
| При испарении энтропия системы в парообразном состоянии: | не изменяется | увеличивается | уменьшается | |
| Самопроизвольное протекание химической реакции возможно, если: | DU0 > 0 | DG0 > 0 | DG0 < 0 | |
| При каком условии в системе наступает состояние термодинамического равновесия? | DH0 = 0 | DS0 = 0 | DG0 = 0 | |
| Какой знак имеет DS0 в процессе возгонки: CO2 (тв) = CO2 (г) : | больше нуля | меньше нуля | равно нулю | |
| Каким символом обозначают изменение свободной энергии в ходе химического процесса? | DS | DG | DH | |
| Какое математическое выражение отражает 1-й закон термодинамики для изобарных процессов: | DG = DH – ТDS | Q = DU + pDV | DH = DH2 – DH1 | |
| 1-ое следствие из закона Гесса отражается математическим уравнением: | -DH образования вещества из простых веществ = DH разложения вещества на простые вещества | Q = -DH | Q = DU | |
| Равенство энтальпийного и энтропийного факторов (DH0 298 = TDS0 298) характерно для: | начала реакции | термодинамического равновесия | окончания реакции |
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
| Ва-ри-ант | Задание | Варианты ответа | ||
| Стандартные значения энтропии образования простых веществ: | равны нулю | меньше нуля | не равны нулю | |
| Какое выражение соответствует изменению энтальпии химической реакции 2СО(г) + O2 (г) = 2СО2(г)? | DH0 реакции = 2DH0СО2(г) – 2DH0СО(г) | DH0 реакции = 2DH0СО2(г) – (2DH0СО(г) + DH0О2 (г)) | DH0 реакции = 2DH0СО(г) – 2DH0СО2(г) | |
| Формулировка какого закона приведена: «Тепловой эффект химической реакции не зависит от пути, по которому она протекает, а определяется только природой и состоянием исходных веществ и продуктов реакции»? | закона Гесса | второго закона термодинамики | первого закона термодинамики | |
| В каких единицах выражается тепловой эффект реакции? | кДж | градус Цельсия | градус Кельвина | |
| Термохимические уравнения отличаются от химических тем, что в них указываются: | агрегатные состояния веществ | степени окисления элементов | агрегатные состояния веществ и тепловой эффект | |
| Какие условия в термохимии являются стандартными? | Т = 298 К; р = 101,3 кПа; С = 1 моль/кг | Т = 273 К; р = 101,3 кПа; С = 1 моль/кг | Т = 298 К; р = 101,3 кПа; С = 0,5 моль/кг | |
| Математическое выражение изменения свободной энергии: | DG = DH – ТDS | Q = DU | Q = -DH | |
| Термохимическим уравнением является: | S(тв) + O2(г) = SO2 (г), DH0298 = -297 кДж/моль | S(тв) + O2(г) = SO2 (г) | S + O2 = SO2, DH0298 = -297 кДж/моль | |
| Согласно закону Гесса, тепловой эффект химической реакции зависит: | от присутствия катализатора | от пути перехода системы из одного состояния в другое | от начального и конечного состояния химической системы | |
| В результате реакции, протекающей с уменьшением объема газообразных веществ, энтропия системы: | увеличивается | остается неизмен-ной | уменьшается |
Продолжение таблицы 3.20 – Тестовое задание 11 (Т-11)
| Ва-ри-ант | Задание | Варианты ответа | ||
| Наиболее термодинамически устойчивым является соединение: | СО (г) DH0СО(г) = -110,5 кДж/моль | СО2 (г) DH0СО2(г) = -393,51 кДж/моль | СН4 (г) DH0СН4(г) = -74,85 кДж/моль | |
| В прямом направлении при стандартных условиях процесс протекает самопроизвольно, если: | DS>0; DH>0, при этом DH>ТDS | DS>0; DH<0 | DG>0 | |
| Система находится в состоянии термодинамического равновесия, если: | DS<0; DH>0 | DS>0; DH<0 | DH = ТDS | |
| Физико-химические процессы при стандартных условиях не могут протекать в прямом направлении при стандартных условиях, если: | DS<0; DH>0 | DS>0; DH<0 | S<0; DH<0, при этом DH>ТDS | |
| В каких единицах выражается изменение энтропии реакции? | кДж/(моль·К) | Дж/(моль·К) | кДж/моль |
Задание 6. Химическая кинетика и химическое равновесие(по разделам стандартов: химическое равновесие, скорость реакции и методы ее регулирования, катализаторы и каталитические системы)
Рекомендуемая литература: [1], гл. 6, разд. 6.2; [2], гл. V, § 5.5, гл. VI, § 6.1, гл. 7; [3], гл. VI; [4], гл. 5, §§ 3-11; лекции.
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:
1.1. Что является предметом изучения химической кинетики.
1.2. По какому признаку все системы и химические реакции делятся на гомогенные и гетерогенные.
1.3. Каковы сущность понятия "скорость химической реакции" и математические выражения скорости гомогенных и гетерогенных реакций.
1.4. Каковы основные положения теории активированных комплексов, определение и физический смысл энергии активации; как выглядят энергетические схемы для экзотермических и эндотермических реакций.
1.5. Каковы основные факторы, влияющие на скорость химических реакций; от какого дополнительного фактора зависит скорость гетерогенных реакций.
1.6. Какие характеристики химических связей и молекул обусловливают природу реагирующих веществ и тем самым влияют на скорость реакций.
1.7. Что представляет собой закон действующих масс, какова его формулировка, влияние какого фактора на скорость химических реакций он выражает. Каково математическое выражение скорости реакции по закону действующих масс (в общем виде и для конкретных реакций).
1.8. От концентрации каких веществ не зависит скорость гетерогенных реакций и почему.
1.9. Каковы сущность понятия "константа скорости химической реакции" и ее физический смысл, От каких факторов она зависит.
1.10. Что представляет собой правило Вант-Гоффа, влияние какого фактора на скорость химических реакций оно выражает. Каковы его формулировка и математическое выражение в общем виде.
1.11. Какие значения в большинстве случаев может принимать температурный коэффициент и каков его физический смысл.
1.12. Какие вещества называют катализаторами; что представляет собой явление катализа. Чем различаются а) положительные и отрицательные катализаторы; б) гомогенные и гетерогенные катализаторы.
1.13. Какие вещества называют инициаторами, а какие – ингибиторами, в чем их отличие от катализаторов.
1.14. По какому признаку все реакции делятся на обратимые и необратимые, в чем их принципиальное различие.
1.15. Когда наступает состояние химического равновесия, что в этот момент происходит с концентрациями веществ. Что понимают под состоянием химического равновесия; почему равновесие называют подвижным, или динамическим.
1.16. Каковы сущность понятия "константа химического равновесия", ее физический смысл и математическое выражение (через константы скоростей и по закону действующих масс).
1.17. От каких факторов зависит константа равновесия, почему она в большинстве случаев не зависит от присутствия катализатора.
1.18. Изменением каких факторов можно смещать равновесие в химических реакциях и почему.
1.19. Каковы формулировка принципа Ле-Шателье и его практическое значение для прогнозирования направления смещения равновесия.
2. Письменное задание для контроля усвоения темы:
Для данной обратимой реакции по Вашему варианту (табл. 3.21):
2.1. Объясните, что представляют собой обратимые реакции, и каковы их признаки. Отразите обратимость в уравнении данной реакции.
2.2. Определите, в гомогенной или гетерогенной системе проходит данная реакция, и объясните почему.
2.3. Определите, экзотермической или эндотермической является прямая реакция (протекающая в прямом направлении) и почему.
2.4. Напишите математическое выражение скоростей прямой и обратной реакций по закону действующих масс через концентрации, а при наличии в системе газов – и через давление.
2.5. Определите расчетным способом, во сколько раз (V2/V1) изменится скорость прямой или обратной реакции (см. задание в табл. 3.21) при указанном изменении концентрации или давления (Т=const). Приведите расчет.
2.6. Определите, во сколько раз увеличится (или уменьшится) скорость прямой реакции при указанном изменении температуры и данном значении температурного коэффициента (см. задание в табл. 3.21; в расчете используйте правило Вант-Гоффа).
2.7. Укажите, при каком кинетическом условии наступает химическое равновесие, и что позволяет достичь смещения равновесия.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 896; Нарушение авторских прав?; Мы поможем в написании вашей работы!