
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 3. 4 страница
|
|
|
|
Задание 18. Химическая связь, строение молекул и пространственная изомерия органических соединений (по разделам стандартов: химическая связь и строение веществ (органических))
Рекомендуемая литература: [1], гл. 29, § 29.3; [2], гл. 13, § 13.1; [4], гл. 13, § 2; лекции.
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:
1.1. Что представляет собой явление гибридизации атомных орбиталей и почему оно происходит.
1.2. Какова электронно-графическая формула атома углерода в основном и возбужденном состояниях; как обозначаются и простанственно изображаются разные виды гибридизации его атомных орбиталей.
1.3. Какова пространственная направленность гибридизованных орбиталей sp, sp2 и sp3 и какие значения имеют валентные углы между ними.
1.4. Как образуются s-связи в молекулах органических соединений, какие орбитали и каким образом перекрываются при их образовании.
1.5. Как образуются p-связи, какие орбитали и каким образом перекрываются при их образовании.
1.6. Какие существуют разновидности кратных связей (в зависимости от вида гибридизации орбиталей атомов углерода, их образующих), каковы различия между их прочностью и поляризуемостью.
1.7. Какова сущность явления сопряжения в органических молекулах, в чем заключается различие между p,p- и p,p-сопряжением. Уметь изобразить в виде схем различные виды сопряжения, возникающие в молекулах органических соединений.
1.8. Как различаются по степени прочности s-, p- и сопряженные связи, и с чем это связано.
1.9. Что представляют собой пространственные изомеры, какие существуют разновидности (типы) пространственных изомеров.
1.10. Каковы признаки строения молекулы органического соединения, указывающие на наличие у него геометрических (цис -, транс -) изомеров; чем геометрические изомеры отличаются друг от друга. Уметь привести примеры таких изомеров.
1.11. Каковы признаки строения молекулы органического соединения, указывающие на наличие у него оптических (зеркальных) изомеров; чем оптические изомеры отличаются друг от друга. Уметь привести примеры таких изомеров.
2. Письменное задание для контроля усвоения темы:
В таблице 3.52 даны структурные формулы органических соединений. Для данного в Вашем варианте соединения:
2.1. Изобразите в структурном виде его функциональные группы.
2.2. Определите его класс и дайте название по систематической номенклатуре.
2.3. Укажите символами (sp, sp2, sp3) вид гибридизации атомных орбиталей каждого атома углерода, в том числе и в составе углеродсодержащих функциональных групп.
2.4. Для данной молекулы постройте схемы перекрывания атомных орбиталей (с полным изображением всех орбиталей каждого атома):
– при образовании одной углерод-углеродной одинарной s-связи (по выбору с указанием номеров углеродных атомов);
– кратной связи (s- и p-связей в ней);
– связи углерод – гетероатом (С-Х).
2.5. Укажите пространственную направленность гибридизованных орбиталей при образовании s-связей в схемах, построенных по п. 2.3 (линейная, тригональная, тетраэдрическая), и значения соответствующих валентных углов.
2.6. Для данного вещества изобразите два геометрических и два оптических изомера; объясните, почему эти виды изомерии в данном случае возможны. Укажите, в чем заключается различие между изображенными Вами каждыми двумя изомерами.
Таблица 3.52
| Вариант | Соединение | Вариант | Соединение |
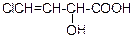
| 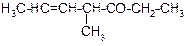
| ||
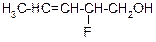
| 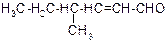
| ||
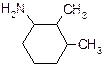
| 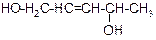
| ||
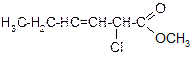
| 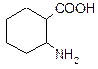
| ||
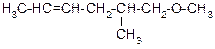
| 
|
Продолжение таблицы 3.52
| Вариант | Соединение | Вариант | Соединение |

| 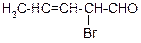
| ||
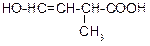
| 
| ||

| 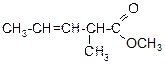
| ||
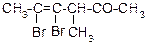
| 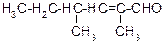
| ||
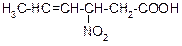
| 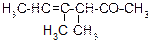
| ||
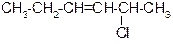
| 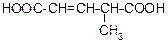
| ||

| 
| ||
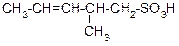
| 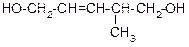
| ||

| 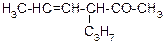
| ||
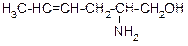
| 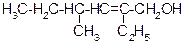
| ||
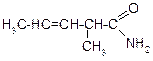
| 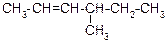
| ||
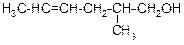
| 
| ||
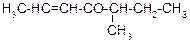
| 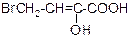
|
Комплексное тестовое задание 13 по теме "Химическая связь, строение молекул и пространственная изомерия органических соединений"
Правильные ответы по п. А приведены в конце пособия в таблице 4.2.
В таблице 3.53 даны органические соединения различных классов.
А. Из набора ответов выберите вещество, которое является структурным изомером исходного соединения.
Б. Определите, к каким классам органических соединений принадлежат исходное вещество и его изомер, изобразите их структурные формулы. Укажите разновидность данной структурной изомерии и признак, по которому Вы это определили. Определите, какие разновидности пространственной изомерии характерны для исходного соединения.
Таблица 3.53 – Тестовое задание 26 (Т-26)
| Ва-ри- ант | Исходное соединение | Набор ответов | ||
| СH3CH2CH2CH2OH | СH3CH2CH2OH | СH3CH=CHCH2OH | СH3CH(OH)CH2CH3 | |
| CH3CH2CHO | CH3CH2CH2CHO | CH3C(O)CH3 | CH3CH2CH2OH | |
| C6H5C(O)CH3 | CH3-C6H4CHO | C6H5CH2C(O)CH3 | CH3-C6H4C(O)CH3 | |
| СН3-С6Н4ОН | С6Н4(ОН)2 | СН3-С6Н4СН2ОН | С6Н5СН2ОН | |
| СН3СН2СН(СН3)СООН | СН3СН(СН3)СООН | СН3СН(СН3)СН2СООН | СН3СН2СН(СН3)СНО | |
| CH3CH2COOCH3 | CH3CH2COOH | CH3COOCH2CH3 | CH3COOCH3 | |
| CH3CHClCH2CH3 | CH3CH2CH2CH2Cl | CH3CHClCH2CH2Cl | CH3CHClCH3 | |
| CH3-C6H4CHO | CH3-C6H4CH2CHO | C6H11CHO | C6H5C(O)CH3 | |
| СH3CH2OCH2CH3 | HOСH2CH2CH2CH3 | СH3CH2OCH2CH2CH3 | HOСH2CH2CH2CH2OH | |
| CH3CHNH2CH3 | CH3CHNH2CH2CH3 | CH3CHNO2CH3 | CH3CH2CH2NH2 | |
| СН3СН=СНСООН | СН2=СНСООСН3 | СН3СН2СН2СООН | СН3СН=СНСН2СООН | |
| CH3CCl=CClCH3 | CH3CH2CCl=CClCH3 | CH3CCl=CHCH2Cl | CH3CHClCHClCH3 | |
| CH3CH2C = CH | CH2=CHCH=CH2 | CH3CH2C=CH | CH3CH2CH2C = CH | |
| CH3CH=CHCHO | CH2=CHCH2CHO | CH3CH2CH=CHCHO | CH3C = CCHO | |
| CH3CH2CHNO2CH3 | CH3CH2CH2CH2NH2 | CH3CH2CH2CH2NO2 | CH3CH2CH2NO2 | |
| CH3-C6H4COOCH3 | CH3-C6H4COOCH2CH3 | CH3-C6H4COOH | C6H5COOCH2CH3 | |
| CH3-C6H4CH2OH | CH3-C6H4CH2OCH3 | C6H5CH2CH2OH | CH3-C6H4OH | |
| CH3CH2CHNH2COOH | H2NCH2CH2CH2COOH | CH3CH2CH2CH2NH2 | CH3CHNH2COOH | |
| С6Н5ОCH3 | С6Н5СНО | С6Н5СН2ОН | С6Н4(ОН)2 | |
| H2NCH2CH2CH2NH2 | H2NCH2CHNH2CH3 | H2NCH2CH=CHNH2 | CH3CH2CH2NH2 | |
| СН2=СНСН2СООН | СН = ССН2СООН | СН2=СНСООН | СН3СН=СНСООН | |
| CH3-C6H4CH2CH3 | CH3-C6H4CH3 | C6H5CH2CH2CH3 | CH3-C6H10CH2CH3 | |
| CH3CH(CH3)CH2CHO | CH3CH2OCH2CH2CH3 | CH3CH2CH(CH3)CHO | CH3CH2CH2CHO | |
| мета- CH3-C6H4SO3H | CH3-C6H4COOH | C6H5SO3H | пара- CH3-C6H4SO3H | |
| CH3CH(OH)CH(OH)CH3 | HOCH2CH2CH2CH2OH | HOCH2CH(OH)CH3 | СH3CH2OCH2CH3 | |
| CH2Br-C6H4CH3 | CH2Br-C6H4CH2Br | Br-C6H4CH3 | Br-C6H4CH2CH3 | |
| HOCH2CH2COOH | HOCH2CH2CH2COOH | CH3CHOHCOOH | HOCH2CH2OH |
Продолжение таблицы 3.53 – Тестовое задание 26 (Т-26)
| Ва-ри- ант | Исходное соединение | Набор ответов |
| CH3-C6H4CОOH | CH3-C6H4CН2СОOH | C6H5CОOCH3 | CH3-C6H10CОOH | |
| СH3CH=CHCH2SO3H | СH2=CHCH2CH2SO3H | СH3CH=CHSO3H | СH3C = CCH2SO3H |
| пара -С6Н4(ОН)2 | С6Н10(ОН)2 | С6Н3(ОН)3 | орто -С6Н4(ОН)2 | |
| CH3CH2-C6H4NH2 | CH3-C6H4NH2 | C6H5CH2CH2NH2 | CH3CH2-C6H10NH2 | |
| C2H5OH | CH3C(O)CH3 | CH3CHO | CH3OCH3 | |
| НООССН2СН2СООН | НООССН2СООСН3 | НООССН2СООН | НООССН=СНСООН | |
| CH3CH2CH=CHNO2 | CH3CH=CHNO2 | CH3CH2CH2CH2NO2 | CH3CH=CHCH2NO2 | |
| CH2=CHCH2CHO | CH2=CHC(O)CH3 | CH2=CHCHO | CH2=CHCH2CH2OH |
Задание 19. Химические свойства и химическая идентификация углеводородов (по разделам стандартов: реакционная способность и химическая идентификация веществ (органических); связь химических свойств со структурой молекул; мономеры)
Рекомендуемая литература: [1], гл. 29, § 29.5-29.8; [2], гл. 13, § 13.2; лекции.
1. Вопросы, которые необходимо изучить и уметь дать на них ответ:
1.1. Что собой представляют углеводороды по химическому составу, на какие ряды по форме углеродной цепи они подразделяются.
1.2. Какие существуют гомологические ряды углеводородов; каковы названия, основоположники и общие формулы этих рядов (для углеводородов гомологические ряды совпадают с классами).
1.3. В чем заключаются принципиальные отличия в строении и свойствах s- и p-связей; как это согласуется с положениями теории химического строения Бутлерова о взаимосвязи строения и свойств веществ. Что представляет собой явление сопряжения в молекулах органических соединений, и в каких случаях оно возможно.
1.4. Какие типы реакций и почему характерны для алканов и циклоалканов (от С5 и выше), каковы их главные разновидности (определяемые по типу второго реагента). Почему алканы и высшие циклоалканы обладают сходными химическими свойствами.
1.5. Какие типы реакций и почему характерны для непредельных углеводородов, каковы их главные разновидности (определяемые по типу второго реагента).
1.6. Почему алкины проявляют свойства С-Н кислот, а алкены такими свойствами не обладают.
1.7. Какие типы реакций и почему характерны для ароматических колец бензола и его гомологов, каковы их главные разновидности (определяемые по типу второго реагента). Какие специальные условия необходимы для реакций присоединения по бензольному кольцу или его расщепления и почему.
1.8. Что собой представляет автоокисление углеводородов, по какому механизму проходит этот процесс, каков состав его промежуточных и конечных продуктов.
1.9. Какие конкретные химические реакции являются отличительными для углеводородов разных классов и могут быть использованы для их химической идентификации.
1.10. Уметь подтвердить ответы на п.п. 1.4-1.8 уравнениями соответствующих реакций.
2. Письменное задание для контроля усвоения темы:
В таблице 3.54 приведены два исходных углеводорода различных классов, которые для углеводородов совпадают с их гомологическими рядами. Также приведен реагент, который может вступить в реакцию только с одним из данных углеводородов, и поэтому является реактивом именно на это соединение.
Для данных в Вашем варианте углеводородов и реактива выполните следующие задания:
2.1. Приведите структурные формулы и названия исходных углеводородов и реактива, укажите класс реактива. Определите, к какому гомологическому ряду принадлежит каждый из данных Вам углеводородов. Дайте названия этих гомологических рядов и общие гомологические формулы; для каждого данного углеводорода приведите структурную формулу одного из его ближайших гомологов.
2.2. Во всех несимметричных молекулах данных веществ укажите направления смещения электронной плотности, символы и знаки электронных эффектов, возникающие частичные заряды на атомах.
2.3. Определите, какой из углеводородов вступит в реакцию с данным реактивом в указанных условиях, и объясните почему.
2.4. Укажите, какая связь в молекуле углеводорода будет разрываться в ходе его реакции с данным реактивом в указанных условиях, и как на ее разрыв влияют прочность связи и условия проведения процесса.
2.5. Напишите уравнение возможной химической реакции одного из данных углеводородов с данным реактивом (см. примечание). Укажите классы и названия образующихся продуктов. Укажите, имеется ли в этой реакции аналитический сигнал (изменение окраски, рН, степени дисперсности реакционной среды; образование нерастворимых или газообразных продуктов). Может ли эта реакция являться качественной для рассматриваемого класса углеводородов.
2.6. Если в реакцию по п. 2.5 вступает бензол или его гомолог, то объясните, каковы особенности строения и химических свойств его цикла и какова сущность понятий "сопряжение" и "ароматичность".
2.7. Определите, по какому механизму (радикальному или ионному) произойдет разрыв связи в молекулах реагирующих веществ и объясните почему.
2.8. Определите, к какой разновидности относится рассматриваемая реакция (замещение, обмен, присоединение, расщепление) и укажите, какими признаками это подтверждается.
Рядом с уравнением реакции (справа) символически обозначьте ее механизм (SR, SE, SN, AR, AE, AN).
2.9. Изложите современную трактовку правила Марковникова для реакций присоединения и укажите, реализуется ли это правило в Вашей реакции и каким образом.
Примечание: примите во внимание следующее:
а) при ответе на п. 2.5 в реакции с алкинами используйте мольное соотношение углеводород: реактив = 1: 1;
б) молекулы большинства реактивов, данных в таблице 3.54, условно могут быть изображены формулами H-Y и A-X:
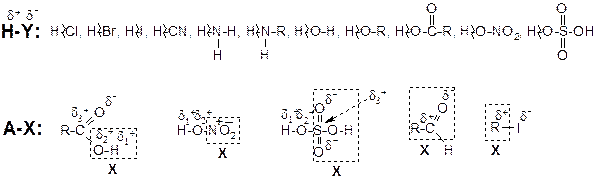
В формулах обозначены частичные заряды (d), возникающие на атомах в результате их взаимного влияния в молекуле;
в) в ходе реакций присоединения в молекуле реактива происходит разрыв связей Hd+–Yd-, и в случаях ионного механизма образуются электрофил (Н+) и нуклеофил (Y-);
г) в реакциях замещения происходит разрыв связи А–Х, и водород в молекуле исходного углеводорода замещается на фрагмент Х.
Таблица 3.54
| Ва- ри-ант | Исходные углеводороды | Реактив (особые условия) | Ва- ри- ант | Исходные углеводороды | Реактив (особые условия) |
| C3H8, C3H6 | HCl | C3H8, C3H6 | СH3CH2NH2 (катализ) | ||
| C3H4, C3H6 | Cu(OH)2 (в аммиачном растворе) | C6H14, C6H6 | сульфохлорирование: SO2, Cl2 (облучение) |
Продолжение таблицы 3.54
| Ва- ри-ант | Исходные углеводороды | Реактив (особые условия) | Ва- ри- ант | Исходные углеводороды | Реактив (особые условия) |
| сульфоокисление: SO2, O2 (облучение) | C2H6, C2H4 | O2 (катализатор серебро, нагрев до 350 0С) | ||
| C2H4, C2H6 | СH3-CH2-OH (катализ) | C3H4, C3H8 | CH3-COOH (катализ) | ||

| H2O (катализ) | C6H6, C6H14 | разб. HNO3 (нагрев до 140 0С) | ||
| C4H10, CH2=CH-CH=CH2 | Br2 (раствор, норм. условия) | C2H6, C2H4 | NH3 (катализ) | ||
| C3H4, C3H8 | HBr | 
| H2 (катализ) | ||
| автоокисление O2 воздуха (норм. условия) | C2H2, C2H6 | HCN (катализ) | ||
| C6H14, C6H6 | конц. HNO3 в присут. H2SO4, нагрев | C6H6, C6H14 | CH3I (катализатор AlCl3) | ||
| С4Н8, С4Н10 | HI | C3H4, C3H8 | HCN (катализ) | ||
| CH3-C≡C-CH3, CH3-CH2-C≡CH | Ag2О (в аммиачном растворе) | 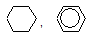
| Br2 (катализатор FeBr3) | ||
| CH2=CH-CH=CH2, C4H10 | HBr | C4H8, C4H10 |  (катализ)
(катализ)
| ||
| C3H8, C3H6 | H2SO4 (норм. условия) | C2H2, C2H6 | HCl | ||
| C4H10, C4H8 | O + HOH (KMnO4 в слабощел. среде) | C2H2, C2H4 | HOH (катализ) | ||
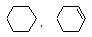
| Br2 (раствор, норм. условия) | C2H2, C2H6 | Cl2 (норм. условия) | ||
| C5H12, C5H10 | HCN (катализ) | 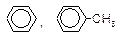
| Br2 (иници-ирование) | ||
| C3H4, C3H8 | CH3OH (катализ) | C3H8, C3H6 | HNO3 (норм. условия) | ||
| C6H14, C6H6 | O2 (катализ, 100-110 0С) | C3H4, C3H8 | СH3NH2 (катализ) |
Задание 20. Химические свойства и идентификация производных углеводородов (по разделам стандартов: реакционная способность и химическая идентификация веществ (органических); связь химических свойств со структурой молекул; мономеры)
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 493; Нарушение авторских прав?; Мы поможем в написании вашей работы!