
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При применении метода кулонометрии. Практическое применение методов электрогравиметрии, кондуктометрии и кулонометрии для контроля качества продукции
|
|
|
|
Определение количественного состава анализируемой пробы
Практическое занятие № 16
И продовольственных товаров
Для контроля качества и безопасности промышленных
Потенциометрический анализ и особенности его применения
Практическое занятие № 15
Цель: Изучение теоретических основ потенциометрии и анализ условий ее практической реализации при определении конкретных показателей качествапромышленных и продовольственных товаров.
План занятия:
1 Опрос студентов
ü Сущность метода;
ü Классификация потенциометрических методов анализа;
ü Характеристики ионоселективных электродов;
ü Классификация ионоселективных электродов;
ü рН-электрод;
ü Прямая потенциометрия: этапы анализа, характеристики метода, практическое применение;
ü Потенциометрическое титрование: этапы анализа, характеристики метода, практическое применение.
2 Тестовая работа
Тестовая работа (конкретные задания и форма их представления) готовиться преподавателем. Перечень примерных тестовых вопросов приведен в Приложении Л.
Тестовая работа выполняется индивидуально в течение 15 минут.
3 Индивидуальное задание. Проанализировать условия проведения потенциометрического анализа на примере стандартных методик выполнения измерений.
Для выполнения задания необходимо иметь:
ü ТНПА в соответствии с перечнем, приведенным в Приложении М (таблица М.1 – для специализации «Сертификация промышленных товаров», таблица М.2 – для специализации «Сертификация продовольственных товаров»).
Результаты представляются в таблице по форме приведенной ниже (таблица 10).
Таблица 10
Форма представления результатов выполнения индивидуального задания
| Обозначение и наименование ТНПА | ||||||
| Определяемый компонент | Сущность метода | Средства измерений | Этапы анализа | Условия проведения анализа | Метрологи- ческие характеристики | |
| наименование | значение | |||||
При заполнении первой графы таблицы обязательно приводить структурные химические формулы с указанием названий соединений и ионов, второй – уравнений реакций, лежащих в основе метода. При заполнении четвертой графы учесть, что этапы анализа должны быть сформулированы в общем виде. В седьмой – необходимо представлять конкретные цифровые данные метрологических характеристик.
Цель: Получение практических навыков в расчетах по кулонометрии и анализ условий практической реализации методов электрогравиметрии, кондуктометрии и кулонометрии при определении в продукции конкретных показателей качества.
План занятия:
1 Теоретическая часть
Кулонометрия основана на использовании законов Фарадея для определения количества вещества, которое прореагировало или образовалось при протекании электродной реакции:1. Количество вещества, электропревращенного в процессе электролиза (восстановленного или окисленного), прямо пропорционально количеству электричества, протекшего через электролит;2. При протекании одинакового количества электричества через разные электролиты выделяются или растворяются количества веществ, прямо пропорциональные их электрохимическим эквивалентам.Электрохимический эквивалент – это масса вещества, выделившегося на электроде или растворившегося с него при протекании через электролит единицы количества электричества, то есть 1 Кл.Для выделения в процессе электролиза 1 моль эквивалентов любого вещества требуется количество электричества, равное 1 фарадею, который составляет 96458 Кл.Масса электрохимически окисленного или восстановленного вещества может быть вычислена по формуле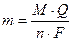 , где m – масса вещества (г), выделившегося в ходе электролиза; M – молярная или атомная масса (г/моль); Q – измеренное количество электричества (Кл), равное произведению силы тока на время Q = I · t (1 Кл = 1 А·с); n – число электронов, участвующих в электрохимическом процессе; F – число Фарадея, электрохимический эквивалент моля, равное
, где m – масса вещества (г), выделившегося в ходе электролиза; M – молярная или атомная масса (г/моль); Q – измеренное количество электричества (Кл), равное произведению силы тока на время Q = I · t (1 Кл = 1 А·с); n – число электронов, участвующих в электрохимическом процессе; F – число Фарадея, электрохимический эквивалент моля, равное 96485 Кл/моль. Кулонометрический анализ возможен при следующих условиях:– в результате электрохимического окисления или восстановления должен образовываться продукт известной степени окисления;– взаимодействие электронов с ионами или молекулами определяемого вещества должно протекать стехиометрично, со 100 %-ным выходом по току (без побочных реакций);– определение должно удовлетворять требуемой аналитической точности.Кулонометрические определения проводятся в виде прямой кулонометрии и в виде кулонометрического титрования.Прямая кулонометрия основана на непосредственном электропре-вращении определяемого вещества на электроде. Поэтому метод можно использовать для определения только электроактивных веществ. Прямая кулонометрия проводится либо при постоянной силе тока (гальваностатически), либо при постоянном потенциале (потенциостатически). Метод имеет высокую точность, однако и в гальваностатическом, и в потенциостатическом варианте проведения анализа трудно исключить протекание побочных реакций. Пример 1. Навеску сплава массой 0,6578 г растворили и через полученный раствор в течение 20,0 мин пропускали ток силой 0,2 А, в результате чего на катоде полностью выделилась медь. Определить массовую долю (%) меди в сплаве, если выход по току составлял 80,0 %. Решение В соответствии с законом Фарадея
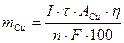 , где m – масса вещества (г), выделившегося в ходе электролиза; I – сила тока, А; τ – время электролиза, с;А –атомная масса меди; η – выход по току, %; n – число электронов, участвующих в электрохимическом процессе; F – число Фарадея, электрохимический эквивалент моля, равное
, где m – масса вещества (г), выделившегося в ходе электролиза; I – сила тока, А; τ – время электролиза, с;А –атомная масса меди; η – выход по току, %; n – число электронов, участвующих в электрохимическом процессе; F – число Фарадея, электрохимический эквивалент моля, равное 96485 Кл/моль. Массовая доля (%) меди в сплаве равна:
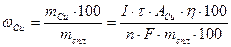 . Подставляя числовые значения, получаем:
. Подставляя числовые значения, получаем: 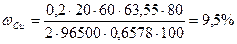 2 Групповое задание №1. Решение задач Последовательность оформления решения задачи:1. Полностью переписать условие задачи;2. Записать уравнение реакции, лежащие в основе расчетов;4. Привести подробное обоснование решения и необходимые вычисления.
2 Групповое задание №1. Решение задач Последовательность оформления решения задачи:1. Полностью переписать условие задачи;2. Записать уравнение реакции, лежащие в основе расчетов;4. Привести подробное обоснование решения и необходимые вычисления.
Задача № 1. Навеску цветного метала массой m (г) растворили и путем электролиза при постоянной силе тока I за время τ выделили полностью на катоде медь и на аноде свинец в виде PbO2. Определить массовую долю (%) меди и свинца в сплаве, если выход по току составлял 100 %:
| Вариант | 1 | 2 | 3 | 4 |
| m, г | 1,525 | 1,442 | 1,811 | 1,621 |
| I, А | 0,20 | 0,15 | 0,22 | 0,18 |
| τ, мин | 45,0 | 50,0 | 40,0 | 38,0 |
Задача № 2. Для получения амальгамы кадмия через раствор CdSO4 пропускали ток силой I в течение 5 мин. Рассчитать массовую долю (%) кадмия в амальгаме, если для ее получения было взято в качестве катода m (г) ртути:
| Вариант | 1 | 2 | 3 | 4 |
| I, А | 0,5 | 0,7 | 0,8 | 1,0 |
| m, г | 10,0 | 12,0 | 13,0 | 11,0 |
3 Групповое задание № 2. Проанализировать условия проведения электрогравиметрических, кондуктометрических и кулонометрического анализа на примере стандартных методик выполнения измерений.
Для выполнения задания необходимо иметь:
ü ТНПА в соответствии с перечнем, приведенным в Приложении Н (таблица Н.1 – для специализации «Сертификация промышленных товаров», таблица Н.2 – для специализации «Сертификация продовольственных товаров»).
Результаты представляются в таблице по форме приведенной ниже.
Таблица 10
Форма представления результатов выполнения индивидуального задания
| Обозначение и наименование ТНПА | ||||||
| Определяемый компонент | Сущность метода | Средства измерений | Этапы анализа | Условия проведения анализа | Метрологи- ческие характеристики | |
| наименование | значение | |||||
При заполнении первой графы таблицы обязательно приводить структурные химические формулы с указанием названий соединений и ионов, второй – уравнений реакций, лежащих в основе метода. При заполнении четвертой графы учесть, что этапы анализа должны быть сформулированы в общем виде. В седьмой – необходимо представлять конкретные цифровые данные метрологических характеристик.
Раздел 7. Современные вопросы химико-аналитического контроля
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 1180; Нарушение авторских прав?; Мы поможем в написании вашей работы!