
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение количественного состава анализируемой пробы при применении потенциометрического титрования
|
|
|
|
Практическое занятие № 14
Цель: Получение практических навыков в расчетах по потенциометрическому титрованию.
План занятия:
1 Теоретическая часть
Потенциометрия и потенциометрическое титрование основано на существовании зависимости равновесного потенциала электрода от активности (концентрации) определяемого иона, описываемой уравнением Нернста. Косвенная потенциометрия или потенциометрическое титрование основано на измерении в анализируемом растворе потенциала электрода, меняющегося в ходе протекания химической реакции при изменении концентрации определяемого иона. В ходе титрования потенциал измеряют после добавления каждой порции титранта. При приближении к концу титрования величина потенциала начинает быстро меняться (скачок титрования). Точку конца титрования определяют по самому резкому изменению величины потенциала в этой области.Экспериментальные данные записываются в виде таблицы, содержащей значения объема прибавляемого титранта V т и соответствующего значения потенциала E. По полученным данным строится кривая потенциометрического титрования в интегральной форме в координатах Е – V т, по точке перегиба которой определяется точка эквивалентности V экв. Зная концентрацию стандартного раствора и объем титранта, пошедший на титрование, рассчитывают содержание определяемого иона в растворе. Если точку эквивалентности по полученным данным определить сложно (пологая кривая), то точность нахождения конечной точки можно повысить путем дифференцирования кривой титрования, построив ее в виде первой производной ∆ E /∆ V – V. В потенциометрическом титровании используют кислотно-основные, окислительно-восстановительные, осадительные и комплексонометрические реакции. При этом можно титровать окрашенные и мутные растворы, анализировать смеси близких по своим свойствам веществ без их предварительного разделения, поскольку при построении кривой титрования по отдельным точкам на ней будет отмечено несколько скачков титрования. Скорость определения при анализе сложных производственных объектов значительно увеличивается по сравнению с классическими титриметрическими методами с визуальной индикацией конечной точки титрования. Пример 1. В навеске сплава массой 1,2500 определяли содержание хрома потенциометрическим титрованием. При растворении сплава хром окислили до хромовой кислоты H2CrO4. Титрование проводили раствором сульфата железа (II) с концентрацией Т (FeSO4/Cr) = 0,005020 г/мл. Вычислить массовую долю (масс. %) хрома в сплаве по следующим данным потенциометрического титрования.
| V (FeSO4), см3 | E, В | V (FeSO4), см3 | E, В | V (FeSO4), см3 | E, В |
| 5 | 600 | 11 | 725 | 15,3 | 953 |
| 6 | 610 | 12 | 765 | 15,4 | 977 |
| 7 | 620 | 13 | 805 | 15,5 | 982 |
| 8 | 635 | 14 | 855 | 16 | 990 |
| 9 | 660 | 15 | 915 | 17 | 995 |
| 10 | 690 | 15,2 | 935 | 20 | 997 |
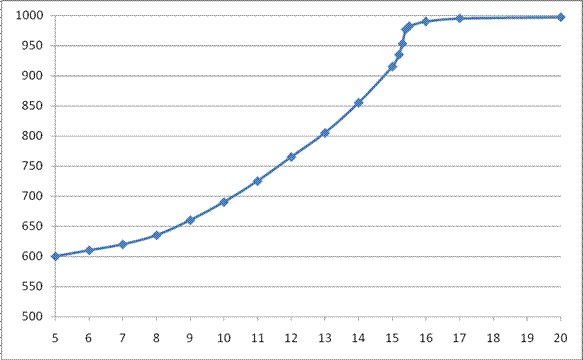 Рис. 6. Интегральная кривая потенциометрического титрованияхрома (VI) рабочим раствором железа (II) По этой кривой сложно определить точку конца титрования. Поэтому переходим к построению кривой титрования в виде первой производной функции Е = f (V).3. Вычисление отношений ∆ E /∆ V и запись их в соответствующую таблицу. На основе исходных данных вычислим отношения ∆E/∆V и сопоставим их с соответствующими объемами (таблица 9). Таблица 9 Данные для построения первой производной кривой потенциометрического титрования хрома (VI) рабочим раствором железа (II)
Рис. 6. Интегральная кривая потенциометрического титрованияхрома (VI) рабочим раствором железа (II) По этой кривой сложно определить точку конца титрования. Поэтому переходим к построению кривой титрования в виде первой производной функции Е = f (V).3. Вычисление отношений ∆ E /∆ V и запись их в соответствующую таблицу. На основе исходных данных вычислим отношения ∆E/∆V и сопоставим их с соответствующими объемами (таблица 9). Таблица 9 Данные для построения первой производной кривой потенциометрического титрования хрома (VI) рабочим раствором железа (II) | V (FeSO4), см3 | ∆E, В | V (FeSO4), см3 | ∆E, В | V (FeSO4), см3 | ∆E, В |
| 6 | 10 | 12 | 40 | 15,4 | 240 |
| 7 | 20 | 13 | 40 | 15,5 | 50 |
| 8 | 15 | 14 | 50 | 16 | 16 |
| 9 | 25 | 15 | 60 | 17 | 5 |
| 10 | 30 | 15,2 | 100 | 20 | 0,66 |
| 11 | 35 | 15,3 | 180 |
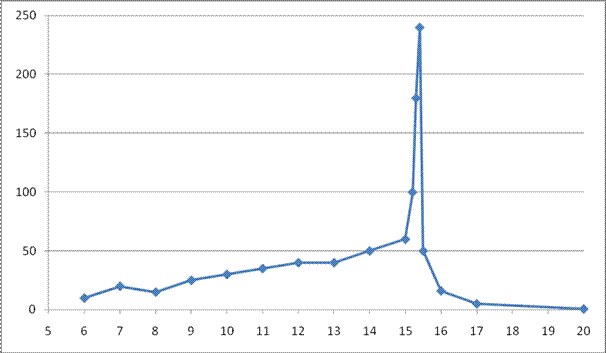 Рис. 7. Кривая потенциометрического титрования хрома (VI) рабочим раствором железа(II) в координатах ∆ E /∆ V – V 5. Определение конечной точки титрования V экв.(FeSO4). В данном случае конечную точку титрования V экв. (FeSO4) можно определить только по последнему варианту кривой титрования (рисунок 7). В этом случае она определяется очень четко: V экв. (FeSO4) = 15,4 см3.6. Расчет массы хрома в анализируемом растворе. По условию задачи известен титр рабочего раствора сульфата железа по определяемому веществу – хрому, то есть количество граммов хрома, эквивалентное в данной реакции 1 см3 рабочего раствора – сульфата железа. Эта величина составляет Т (FeSO4/Cr) = 0,005020 г/мл. Эквивалентный объем рабочего раствора сульфата железа найден по графику V экв. (FeSO4) = 15,4 мл. Поэтому масса хрома в анализируемом растворе вычисляется по формуле m (Cr) = Т (FeSO4/Cr) · V экв.(FeSO4) = 0,005020 · 15,4 = 0,07731 г. 7. Расчет массовой доли хрома в анализируемом образце сплава. Зная навеску сплава m обр и массу хрома m (Cr) в этой навеске, можно рассчитать массовую долю хрома (масс. %) в анализируемом образце: ω (Cr) = [ m (Cr) / m обр ] · 100 % = [0,07731/1,2500] · 100 % = 6,18 % 2 Групповое задание. Решение задач Последовательность оформления решения задачи:1. Записать уравнения реакции, протекающей в процессе потенциометрического титрования;2. Построить кривую титрования в координатах Е – V;3. Вычислить отношения ∆ E /∆ V и записать их в соответствующую таблицу;4. Построить кривую титрования в координатах ∆ Е /∆ V – V, правильно подобрав масштаб для более точного определения точки конца титрования;5. Определить конечную точку титрования V экв. по первому графику и его уточненное значение по второму графику;6. Рассчитать массу определяемого элемента в анализируемом растворе;7. Рассчитать массовую долю определяемого элемента в анализируемом образце.
Рис. 7. Кривая потенциометрического титрования хрома (VI) рабочим раствором железа(II) в координатах ∆ E /∆ V – V 5. Определение конечной точки титрования V экв.(FeSO4). В данном случае конечную точку титрования V экв. (FeSO4) можно определить только по последнему варианту кривой титрования (рисунок 7). В этом случае она определяется очень четко: V экв. (FeSO4) = 15,4 см3.6. Расчет массы хрома в анализируемом растворе. По условию задачи известен титр рабочего раствора сульфата железа по определяемому веществу – хрому, то есть количество граммов хрома, эквивалентное в данной реакции 1 см3 рабочего раствора – сульфата железа. Эта величина составляет Т (FeSO4/Cr) = 0,005020 г/мл. Эквивалентный объем рабочего раствора сульфата железа найден по графику V экв. (FeSO4) = 15,4 мл. Поэтому масса хрома в анализируемом растворе вычисляется по формуле m (Cr) = Т (FeSO4/Cr) · V экв.(FeSO4) = 0,005020 · 15,4 = 0,07731 г. 7. Расчет массовой доли хрома в анализируемом образце сплава. Зная навеску сплава m обр и массу хрома m (Cr) в этой навеске, можно рассчитать массовую долю хрома (масс. %) в анализируемом образце: ω (Cr) = [ m (Cr) / m обр ] · 100 % = [0,07731/1,2500] · 100 % = 6,18 % 2 Групповое задание. Решение задач Последовательность оформления решения задачи:1. Записать уравнения реакции, протекающей в процессе потенциометрического титрования;2. Построить кривую титрования в координатах Е – V;3. Вычислить отношения ∆ E /∆ V и записать их в соответствующую таблицу;4. Построить кривую титрования в координатах ∆ Е /∆ V – V, правильно подобрав масштаб для более точного определения точки конца титрования;5. Определить конечную точку титрования V экв. по первому графику и его уточненное значение по второму графику;6. Рассчитать массу определяемого элемента в анализируемом растворе;7. Рассчитать массовую долю определяемого элемента в анализируемом образце. Задача № 1. Навеску установочного вещества Na2CO3 массой 0,2792 г растворили в мерной колбе вместимостью 50,0 см3 и довели раствор до метки ледяной уксусной кислотой. При потенциометрическом титровании 5,0 см3 полученного раствора хлорной кислотой в безводной уксусной кислоте были найдены следующие результаты:
| V (HClO4), см3 | E, мВ | V (HClO4), см3 | E, мВ | V (HClO4), см3 | E, мВ |
| 3,6 | 4,2 | 4,8 | |||
| 3,8 | 4,4 | 5,0 | |||
| 4,0 | 4,6 | 5,2 |
Вычислить молярную концентрацию эквивалента хлорной кислоты.
Задача № 2. Навеску смеси аланина (M = 89,09 г/моль) и фенилаланина (M = 165,2 г/моль) массой 0,4101 г растворили и раствор довели до метки ледяной уксусной кислотой в мерной колбе вместимостью 50,0 см3. При титровании аликвоты объемом 5,0 см3 0,1 M HClO4 (K = 0,992) в безводной уксусной кислоте получили следующие результаты:
| V (HClO4), см3 | E, мВ | V (HClO4), см3 | E, мВ | V (HClO4), см3 | E, мВ |
| 3,0 | 3,6 | 4,2 | |||
| 3,2 | 3,8 | 4,4 | |||
| 3,4 | 4,0 |
Вычислить массовые доли (%) компонентов смеси.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 2401; Нарушение авторских прав?; Мы поможем в написании вашей работы!