
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет кривых титрования
|
|
|
|
Практическое занятие № 9
Цель: Получение практических навыков по расчету и построению кривых титрования.
План занятия:
1 Опрос студентов
ü Что называется кривой титрования;
ü Для какой цели строят кривые титрования;
ü Виды кривых титрования;
ü Правила построения кривых титрования;
ü Способы определения конечной точки титрования;
ü Индикаторы, применяемые в титриметрических методах анализа;
ü Классификация индикаторов.
2 Теоретическая часть
Графическое изображение зависимости концентрации определяемого компонента А или пропорционального ей свойства системы от количества прибавленного титранта называют кривой титрования. Для каждого отдельного случая титрования такая зависимость может быть рассчитана и построена соответствующая кривая титрования, называемая теоретической кривой титрования. На оси абсцисс откладывают объем добавленного титранта или степень оттитрованности (f = VТ/V0).
Если на оси ординат откладывать равновесную концентрацию или интенсивность пропорционального ей свойства системы, получают линейную кривую титрования. Если на оси ординат откладывать не абсолютные значения указанных выше величин, а их логарифм — получают логарифмическую кривую титрования (рисунок 3).
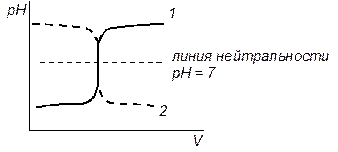
Рис. 3 – Кривые титрования в методе нейтрализации:
1 – кислоту титруют основанием; 2 – основание титруют кислотой
Если константа равновесия реакции титрования достаточно велика, линейная кривая титрования представляет собой две пересекающиеся в точке эквивалентности прямые, если же константа равновесия мала, тогда на кривой титрования нет резкого перегиба. Соответственно, на логарифмической кривой имеется скачок, называемый скачком титрования, причем максимальный наклон кривой соответствует точке эквивалентности.
Наличие скачка на кривой титрования и его величина предопределяют возможность, а также погрешность титриметрического определения. Величина скачка титрования зависит прежде всего от константы равновесия используемой реакции: чем больше константа равновесия, тем больше скачок титрования (рисунок 4), а также от концентрации определяемого компонента А и титранта В. Чем больше их концентрация, тем больше скачок титрования (рисунок 5).

| V | 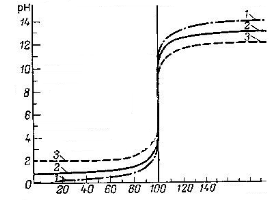
| V |
| Рис. 4. Зависимость величины скачка на кривой титрования от рК титруемой кислоты: 1 – рК = 1; 2 – рК = 5; 3 – рК = 7; 4 – рК = 9 | Рис. 5. Зависимость величины скачка на кривой титрования от концентрации кислоты: 1 – 1М; 2 – 0,1М; 3 – 0,01М |
Для оценки величины скачка титрования необходимо определить положение точек начала и конца скачка титрования. Положение этих точек связывают с допустимой погрешностью определения. Если можно допустить погрешность ±1 %, то точкой начала скачка титрования считают точку кривой титрования при f = 0,99 (недотитрован 1 % от начального количества определяемого компонента), а точкой конца скачка титрования – точку при f =1,01 (добавлен избыток титранта в 1 %). Если допускается погрешность до ±0,1 %, точкой начала скачка считают точку при f = 0,999, а точкой конца скачка – точку при f = 1,001. Если титрование будет закончено в пределах скачка титрования, то погрешность определения не превысит указанных значений.
Чтобы по количеству титранта В, затраченному на реакцию с определяемым компонентом А, можно было рассчитать его количество, желательно прекратить добавление титранта в момент эквивалентности, по крайней мере, с допустимой погрешностью определения необходимо это сделать в пределах скачка титрования. Для этого в процессе титрования нужно получить сигнал, свидетельствующий о том, что скачок титрования достигнут. Такой сигнал получают (определяют конечную точку титрования – КТТ), используя различные средства, позволяющие зафиксировать достижение определенной концентрации какого-либо компонента реакции или определенного уровня интенсивности какого-либо свойства исследуемой системы. Для выбора подходящего средства и способа КТТ используют теоретические кривые титрования.
В химических титриметрических методах количественного анализа используют визуальные способы (безыиндикаторные или индикаторные) фиксирования сигнала о достижении КТТ, в физико-химических методах – инструментальные способы.
Визуально определяют КТТ по появлению или исчезновению окраски титруемого раствора, обусловленной окраской одного из компонентов реакции, а также по образованию или прекращению образования осадка малорастворимого компонента реакции. Эти способы определения КТТ называют безындикаторными. Обычно для определения КТТ используют вспомогательные вещества – индикаторы, которые изменяют окраску, образуют осадок, изменяют цвет люминесценции при достижении определенной концентрации одного из компонентов реакции или определенной интенсивности какого-либо свойства системы. Эти способы определения КТТ называют индикаторными.
В процессе кислотно-основного титрования изменяется pH раствора, поэтому кривые титрования целесообразно строить в координатах pH–f (логарифмическая кривая).
Расчет величины рН производится в зависимости от используемых титруемого вещества и титранта.
2.1 Титрование сильной кислоты сильным основанием
До точки эквивалентности (ТЭ) значение pH определяется только ионами водорода за счет неоттитрованной сильной кислоты:
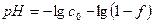
В ТЭ значение pH определяется ионами водорода, поступающими за счет автопротолиза воды:
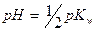
За ТЭ значение pH определяется избытком добавленного титранта – сильного основания:
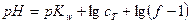
2.2 Титрование слабой кислоты сильным основанием
В начале титрования в растворе находится только слабая кислота:
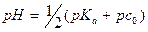
До ТЭ при титровании получается сопряженное основание, и раствор представляет собой буферную смесь:
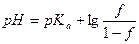
В ТЭ вся кислота оттитрована и pH раствора определяется наличием сопряженного основания:
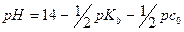
После ТЭ основным источником OH- -ионов будет добавленное основание:
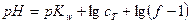
2.3 Титрование слабого основания сильной кислотой
В начале титрования в растворе находится только слабое основание:
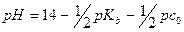
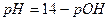
До ТЭ pH рассчитывают по формуле буферной смеси, где Ka – константа кислотности кислоты, сопряженной с титруемым основанием:
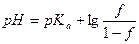
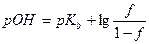 ,
, 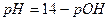
В ТЭ источником ионов H+ является сопряженная кислота:
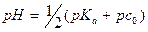
За ТЭ значение pH определяется только добавленной сильной кислотой:
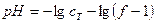
3 Групповое задание. Построение логарифмических кривых титрования для метода нейтрализации. Кривые титрования строятся на основании расчетов с использованием вышеприведенных формул. Результаты расчета оформляются в виде таблицы по следующей форме (таблица 5).
Таблица 5
Форма представления результатов выполнения группового задания
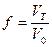
| Состав раствора | pH- определяющий компонент | Формула для расчета pH | Значение pH |
| 0,000 | ||||
| 0,500 | ||||
| 0,900 | ||||
| 0,990 | ||||
| 0,999 | ||||
| 1,000 | ||||
| 1,001 | ||||
| 1,010 | ||||
| 1,100 |
Задача № 1. Построить кривую титрования 0,1 M NaOH раствором 0,1 M HCl. Задача № 2. Построить кривую титрования 0,1 M NH4OH раствором 0,1 M HCl. Задача № 3. Построить кривую титрования 0,1 M CH3COOH раствором 0,1 M NaOH.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 5489; Нарушение авторских прав?; Мы поможем в написании вашей работы!