
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение количественного состава анализируемой пробы
|
|
|
|
Практическое занятие № 5
Контроля товаров
Цель: Получение практических навыков по расчету неизвестной концентрации веществ в анализируемых пробах промышленной и продовольственной продукции.
План занятия:
1 Опрос студентов
ü Аналитический сигнал и его виды;
ü Абсолютные и относительные методы анализа;
ü Понятие раствора, его виды и свойства;
ü Способы определения неизвестной концентрации;
ü Сведения о единицах количества вещества.
2 Теоретическая часть
Концентрация – содержание растворенного вещества в единицах массы или объема раствора или растворителя.
Все способы измерения концентрации разделяют на 2 группы: массовые, объемные.
2.1 Массовые концентрации
Массовая доля (ω., %) – это отношение количества растворенного вещества к массе всего раствора:
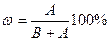 или
или  ,
,
где А – количество растворенного вещества, г;
B – количество растворителя, г;
Vр-ра – объем раствора, см3;
ρ – плотность раствора, г/см3.
На практике под массовой долей понимаютколичество растворенного вещества (г), содержащегося в 100 г раствора:
 ,
,
где mв-ва – масса вещества, г;
mр-ра – масса раствора, г.
Приготовление раствора заданной концентрации из растворов с известными концентрациям с использованием правила креста: количества исходных растворов, необходимых для приготовления смеси, обратно пропорциональны разностям между концентрациями заданного и менее концентрированного; и заданного и более концентрированного растворов, соответственно.
Пример: Сколько г 15 % раствора H2SO4 надо прибавить к 120 г 70 %-ого ее раствора, чтобы получить раствор H2SO4 40 %-й концентрации?
 ,
, 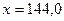 г.
г.
Моляльная концентрация (C, моль/кг). Моляльным называется раствор, содержащий 1 моль растворенного вещества в 1 кг (1000 г) растворителя.
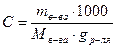 ,
,
где mв-ва – масса вещества, г;
mв-ва – молярная масса вещества, г;
m р-ля – масса растворителя, г;
1000 – коэффициент пересчета на 1000 г.
Титр раствора – масса вещества, содержащегося в 1 см3 раствора.
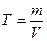 ,
,
где m – масса навески вещества, г;
V – объем раствора, см3.
2.2 Объемные концентрации
Нормальная концентрация (Cн, моль экв/дм3) – это отношение количества эквивалентов растворенного вещества к объему раствора.
Нормальный раствор – это раствор, содержащий 1 эквивалент растворенного вещества, в 1 дм3 раствора.
 ,
,
где mв-ва – масса вещества, г;
Mэкв = Мв-ва ∙ fэкв – молярная масса эквивалента вещества. Под fэкв понимают фактор эквивалентности связанный с числом эквивалентности z, который в свою очередьравен числу эквивалентов вещества, содержащихся в 1 моль этого вещества. Он рассчитывается по формуле: fэкв = 1/z, г/моль экв;
Vр-ра – объем раствора, см3;
1000 – коэффициент пересчета на 1 дм3 раствора.
Молярная концентрация (Cм, моль/ дм3). Молярным называется раствор, содержащий 1 моль растворенного вещества в 1 дм3 раствора:
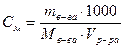 ,
,
где mв-ва – масса вещества, г;
Мв-ва – молярная масса вещества, г/моль;
Vр-ра – объем раствора, см3;
1000 – коэффициент пересчета на 1 дм3 раствора.
Традиционные названия молярной концентрации:
10-1 моль/ дм3 = 0,1 М – децимолярный;
10-2 моль/ дм3 = 0,01 М – сантимолярный;
10-3 моль/ дм3 = 0,001 М – миллимолярный.
Дополнительные единицы измерения концентраций:
Миллионная доля (ppm, от англ. parts per million — частей на миллион, читается пи-пи-эм, «частей на миллион») – аналогична по смыслу проценту или промилле.
1 ppm = 0,001 ‰ = 0,0001 % = 0,000001 = 10−6
1 % = 10000 ppm
1 ‰ = 1000 ppm
Например, если указано, что массовая доля вещества в смеси составляет 15 ppm, это означает, что на каждый килограмм смеси приходится 15 мг этого вещества.
Если же речь идёт об объёмных концентрациях (объёмных долях, долях по объёму), то 1 ppm — это кубический сантиметр (он же миллилитр) на кубический метр (см3/м3).
Миллиардная доля – (ppb, англ. parts per billion, читается пи-пи-би, «частей на миллиард») – аналогична по смыслу проценту или промилле.
1 ppb = 0,000001 ‰ = 0,0000001 % = 10−9
1 % = 10000000 ppb
1 ‰ = 1000000 ppb
2.3 Формулы перехода от одних выражений концентраций растворов к другим
Молярная (Cм, моль/дм3) и нормальная (Cн, моль экв/дм3) концентрации:
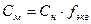
Процентная (ω, г/100 г) и нормальная (Cн, моль экв/дм3) концентрации:

Процентная (ω, г/100 г) и молярная (Cм, моль/дм3) концентрации:
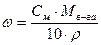
Моляльная (C, моль/кг) и процентная (ω, г/100 г) концентрации:

Моляльная (C, моль/кг) и нормальная (Cн, моль экв/дм3) концентрации:
 .
.
3 Групповое задание. Решение задач
Задача № 1. Для протекания химической реакции необходимо 10 г серной кислоты. В наличие 40 % ее раствор плотностью 1,305 г/см3. Какой объем раствора кислоты необходим?
Задача № 2. Определить масс. (%) концентрацию раствора КСl, содержащего 0,053 кг КСl в 0,5 л раствора плотностью 1063 кг/м3.
Задача № 3. (Задача на правило креста) Сколько г 20 % раствора КОН надо прибавить к 250 г 90 %-го его раствора, чтобы получить раствор КОН 50 %-й концентрации?
Задача № 4. Определить нормальность КОН, если на нейтрализацию 0,035 л 0,3 н Н3РО4 израсходовано 0,02 л его раствора.
Задача № 5. Определить нормальность раствора FeCl3, если в 0,3 л раствора содержится 32,44 г FeCl3.
Задача № 6. Сколько мл 0,1 М раствора Н2SO4 нужно взять для нейтрализации 5 мл 1 М NaOH?
Задача № 7. В 450 г воды растворили 50 г CuSO4∙5H2O. Вычислить %-ое содержание кристаллогидрата и безводной соли.
Задача № 8. Сколько г 5 %-ого раствора можно приготовить из КОН и 100 г Н2О?
Задача № 9. Сколько мл 9,5 %-ого раствора Na2CO3 плотностью 1,1 г/см3 следует добавить к 100 г воды для получения 3 %-го раствора?
Задача № 10. Как приготовить 0,5 л 1,5 М раствора NaClO4 из сухой соли?
Задача № 11. Как приготовить 0,5 л 1,5 М раствора серной кислоты из его 96 %-го раствора плотностью 1,84 г/см3?
Задача № 12. Вычислить молярную и нормальную концентрацию 49 %-го раствора Н3РО4 плотностью 1,33 г/см3.
Задача № 13. Вычислить нормальность, молярность, моляльность 10 %-го раствора СuSO4 плотностью 1107 кг/м3.
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 582; Нарушение авторских прав?; Мы поможем в написании вашей работы!