
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При применении гравиметрического метода анализа
|
|
|
|
Определение количественного состава анализируемой пробы
Практическое занятие № 8
Требования к проведению гравиметрического анализа
Практическое занятие № 7
Цель: Анализ условий проведения гравиметрического анализа при испытании промышленных и продовольственных товаров.
План занятия:
1 Опрос студентов
ü Сущность метода;
ü Классификация гравиметрических методов анализа;
ü Этапы гравиметрического определения;
ü Аналитическая функция;
ü Осаждаемая и гравиметрическая формы;
ü Оптимальные условия осаждения;
ü Причины загрязнения осадка.
2 Групповое задание. Проанализировать условия проведения гравиметрического анализа для конкретной методики выполнения измерений.
Для выполнения задания необходимо иметь:
ü ТНПА, в соответствии с перечнем, приведенным в Приложении Д (таблица Д.1 – для специализации «Сертификация промышленных товаров», таблица Д.2 – для специализации «Сертификация продовольственных товаров»).
Результаты необходимо представить в виде таблицы по нижеприведенной форме (таблица 4).
Таблица 4
Форма представления результатов выполнения группового задания
| Обозначение и наименование ТНПА | ||||
| Определяемый компонент (обозначение ТНПА) | Сущность метода | Этапы анализа | Условия проведения анализа | Осаждаемая форма / Гравиметрическая форма |
При заполнении второй графы таблицы обязательно приводить уравнения реакций, лежащих в основе метода. При заполнении третьей – учесть, что этапы анализа должны быть сформулированы в общем виде. В четвертой графе необходимо представлять конкретные цифровые данные по режимам анализа, в пятой – структурные химические формулы с указанием названий соединений.
Цель: Получение практических навыков в расчетах по гравиметрии.
План занятия:
1 Теоретическая часть
Конечной целью проведения гравиметрического анализа может быть вычисление массового содержания или массовой доли определяемого вещества. Результаты анализа можно выражать по-разному: в виде содержания в пробе элементов (Fe, Cu, P, O, C и т.д.), содержания ионов (например, Ca2+, Mg2+), содержания оксидов (SiO2, Fe2O3, Al2O3, CaO, P2O5 и т.д.).Гравиметрический анализ включает два экспериментальных измерения:– взвешивание навески анализируемого образца mобр .;– взвешивание продукта известного химического состава P, полученного из этой навески в ходе анализа (гравиметрическая или весовая форма), для установления его массы m (P). Гравиметрическая или весовая форма может непосредственно состоять из определяемого компонента A (например, весовая форма имеет состав SiO2 при определении содержания SiO2), либо определяемый компонент входит в состав весовой формы в точно стехиометрических соотношениях (например, при определении содержания серы гравиметрическая форма имеет состав BaSO4). В случае косвенных определений гравиметрическая форма совсем не содержит определяемого компонента, но между ними могут быть установлены точные стехиометрические соотношения. Во всех случаях для достижения конечного результата расчета – вычисления массовой доли определяемого компонента – необходимо массу гравиметрической формы осадка m(P) пересчитать на массу m определяемого компонента А – m(A).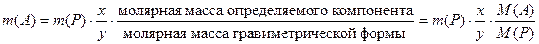 где x и y – целые числа, на которые нужно умножить молярные массы определяемого компонента и гравиметрической формы соответственно, чтобы числа молей в числителе и знаменателе были химически эквивалентны.Вычисленное значение массы определяемого компонента m (A) позволяет рассчитать его массовую долю ω в анализируемом объекте по формуле
где x и y – целые числа, на которые нужно умножить молярные массы определяемого компонента и гравиметрической формы соответственно, чтобы числа молей в числителе и знаменателе были химически эквивалентны.Вычисленное значение массы определяемого компонента m (A) позволяет рассчитать его массовую долю ω в анализируемом объекте по формуле 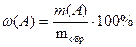
 При любом изменении исходной навески, а, следовательно, и массы конечного продукта – гравиметрической формы, указанное эквивалентное отношение молярных масс в расчете массовой доли определяемого компонента сохраняется постоянным. Это отношение называется гравиметрическим фактором, фактором пересчета или аналитическим множителем и обозначается символом F:
При любом изменении исходной навески, а, следовательно, и массы конечного продукта – гравиметрической формы, указанное эквивалентное отношение молярных масс в расчете массовой доли определяемого компонента сохраняется постоянным. Это отношение называется гравиметрическим фактором, фактором пересчета или аналитическим множителем и обозначается символом F: 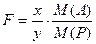 При серийных анализах, то есть при большом потоке анализируемого материала, гравиметрический фактор, для упрощения расчетов, рассчитывают заранее, поскольку он не изменяется при данной выбранной схеме определения.При выполнении методики и обработке результатов гравиметрического анализа можно выделить следующие основные типы расчетов:1. Вычисление фактора пересчета (аналитического множителя, гравиметрического фактора);2. Расчет количества осадителя;3. Расчет навески анализируемого образца;4. Расчет результатов анализа. 1.1 Вычисление фактора пересчета Гравиметрический фактор (или фактор пересчета, или аналитический множитель) F – это эквивалентное отношение молярных масс определяемой и весовой (гравиметрической) формы. Эта величина рассчитывается по-разному в зависимости от состава гравиметрической формы и от стехиометрического соотношения между составом этой формы и составом определяемого компонента. Числовые значения гравиметрических факторов приведены в справочных таблицах. Пример 1. Вычислить аналитический множитель для пересчета сульфата бария на серу и определить сколько граммов серы содержится в 0,2040 г сульфата бария? Решение Из формулы сульфата бария BaSO4 видно, что 1 моль серы эквивалентен 1 моль сульфата бария. Поэтому, в соответствии с определением, вычисляем величину аналитического множителя как отношение молярных масс определяемого вещества – серы и его гравиметрической формы – сульфата бария.
При серийных анализах, то есть при большом потоке анализируемого материала, гравиметрический фактор, для упрощения расчетов, рассчитывают заранее, поскольку он не изменяется при данной выбранной схеме определения.При выполнении методики и обработке результатов гравиметрического анализа можно выделить следующие основные типы расчетов:1. Вычисление фактора пересчета (аналитического множителя, гравиметрического фактора);2. Расчет количества осадителя;3. Расчет навески анализируемого образца;4. Расчет результатов анализа. 1.1 Вычисление фактора пересчета Гравиметрический фактор (или фактор пересчета, или аналитический множитель) F – это эквивалентное отношение молярных масс определяемой и весовой (гравиметрической) формы. Эта величина рассчитывается по-разному в зависимости от состава гравиметрической формы и от стехиометрического соотношения между составом этой формы и составом определяемого компонента. Числовые значения гравиметрических факторов приведены в справочных таблицах. Пример 1. Вычислить аналитический множитель для пересчета сульфата бария на серу и определить сколько граммов серы содержится в 0,2040 г сульфата бария? Решение Из формулы сульфата бария BaSO4 видно, что 1 моль серы эквивалентен 1 моль сульфата бария. Поэтому, в соответствии с определением, вычисляем величину аналитического множителя как отношение молярных масс определяемого вещества – серы и его гравиметрической формы – сульфата бария.  Тогда масса серы, содержащейся в 0,2040 г сульфата бария, равна
Тогда масса серы, содержащейся в 0,2040 г сульфата бария, равна 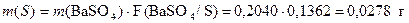 Пример 2. При определении фосфора в чугуне осаждают фосфор в виде (NH4)3PO4 ·12 MoO3, затем осадок растворяют в аммиаке, осаждают молибденовую кислоту раствором ацетата свинца и взвешивают в виде PbMoO4, по массе которого определяют содержание фосфора. Вычислить фактор пересчета для такого определения. Решение Записываем схему определения:P → PO43- → (NH4)3PO4 · 12 MoO3 → 12 PbMoO4.Отсюда
Пример 2. При определении фосфора в чугуне осаждают фосфор в виде (NH4)3PO4 ·12 MoO3, затем осадок растворяют в аммиаке, осаждают молибденовую кислоту раствором ацетата свинца и взвешивают в виде PbMoO4, по массе которого определяют содержание фосфора. Вычислить фактор пересчета для такого определения. Решение Записываем схему определения:P → PO43- → (NH4)3PO4 · 12 MoO3 → 12 PbMoO4.Отсюда  1.2 Расчет количества осадителя Реактивы, которые используют для осаждения, применяют в виде растворов различной концентрации. Для вычисления требуемого объема необходимо по уравнению реакции рассчитать необходимую массу реагента, а затем, зная концентрацию раствора, сделать пересчет на объем. Вычисление необходимого количества реактива не требует особой точно-сти, поскольку на практике для уменьшения потерь при осаждении используют избыток осадителя. Пример 3. Какой объем раствора ацетата свинца с массовой долей 1 % требуется для осаждения молибдена при определении его содержания в ферромолибдене в виде молибденовокислого свинца, если примерное содержание молибдена составляет 50 % (масс.), а навеска образца сплава около 0,25 г? Решение Запишем схему определения: Mo → MoO42- → MoO42- + Pb(CH3COO)2 → PbMoO4 ↓ Молярные массы определяемого вещества и осадителя равны М ( Mo ) = 96 г/моль и М (Pb(CH3COO)2) = 266 г/моль. Масса молибдена в анализируемой навеске сплава равна m ( Mo ) =0,25 · 0,5 = 0,125 г. Составим пропорцию, в соответствии с которой взаимодействуют определяемое вещество и осадитель:96 г Mo – 266 г Pb(CH3COO)20,125 г Mo – m г Pb(CH3COO)2Следовательно, m Pb(CH3COO)2 = (0,125 ∙ 266)/96 = 0,346 г.Учитывая массовую концентрацию раствора, вычисляем требуемую массураствора ацетата свинца m р-ра = (0,346·100)/1 = 34,6 г. Поскольку плотность разбавленного раствора близка к 1 г/см3, вычисленная масса раствора равна его объему. На практике обычно используется полутора-двукратный объем осадителя. Следовательно, для полноты осаждения необходимо взять примерно 70 мл раствора ацетата свинца. 1.3 Расчет навески анализируемого образца Перед началом анализа необходимо приблизительно знать, сколько определяемой составной части содержится в анализируемом образце. На этом основании рассчитывают, сколько надо взять вещества для анализа, то есть какую навеску необходимо взять. Этот расчет обязательно должен предшествовать анализу во избежание получения слишком малого или, наоборот, слишком большого количества прокаленного осадка. При слишком малой массе осадка неизбежные потери на всех стадиях анализа, неточность аналитических весов внесут слишком значительную (в долевом отношении) ошибку. Если взять слишком большую навеску, при осаждении получится столь большое количество осадка, что его невозможно будет тщательно промыть. При расчете навески обычно достаточно определить только два первых знака, но само взвешивание, конечно, проводят с обычной аналитической точностью, то есть до четвертого знака. Пример 4. Какую навеску феррованадия, содержащего примерно 0,10–0,15 % (масс.) фосфора, следует взять для точного определения его содержания в сплаве, если фосфор осаждают в виде фосфорномолибденовоаммонийной соли (NH4)3PO4 · 12 MoO3 ·2H2O, которую высушивают и прокаливают до получения P2O5 ·24MoO3? Масса получаемого осадка примерно 0,1 г. Решение Сначала составляем схему анализа: Р → (NH4)3 PO4 · 12 MoO3 ·2H2O → P2O5 ·24MoO3. На ее основе вычисляем фактор пересчета для данного определения:
1.2 Расчет количества осадителя Реактивы, которые используют для осаждения, применяют в виде растворов различной концентрации. Для вычисления требуемого объема необходимо по уравнению реакции рассчитать необходимую массу реагента, а затем, зная концентрацию раствора, сделать пересчет на объем. Вычисление необходимого количества реактива не требует особой точно-сти, поскольку на практике для уменьшения потерь при осаждении используют избыток осадителя. Пример 3. Какой объем раствора ацетата свинца с массовой долей 1 % требуется для осаждения молибдена при определении его содержания в ферромолибдене в виде молибденовокислого свинца, если примерное содержание молибдена составляет 50 % (масс.), а навеска образца сплава около 0,25 г? Решение Запишем схему определения: Mo → MoO42- → MoO42- + Pb(CH3COO)2 → PbMoO4 ↓ Молярные массы определяемого вещества и осадителя равны М ( Mo ) = 96 г/моль и М (Pb(CH3COO)2) = 266 г/моль. Масса молибдена в анализируемой навеске сплава равна m ( Mo ) =0,25 · 0,5 = 0,125 г. Составим пропорцию, в соответствии с которой взаимодействуют определяемое вещество и осадитель:96 г Mo – 266 г Pb(CH3COO)20,125 г Mo – m г Pb(CH3COO)2Следовательно, m Pb(CH3COO)2 = (0,125 ∙ 266)/96 = 0,346 г.Учитывая массовую концентрацию раствора, вычисляем требуемую массураствора ацетата свинца m р-ра = (0,346·100)/1 = 34,6 г. Поскольку плотность разбавленного раствора близка к 1 г/см3, вычисленная масса раствора равна его объему. На практике обычно используется полутора-двукратный объем осадителя. Следовательно, для полноты осаждения необходимо взять примерно 70 мл раствора ацетата свинца. 1.3 Расчет навески анализируемого образца Перед началом анализа необходимо приблизительно знать, сколько определяемой составной части содержится в анализируемом образце. На этом основании рассчитывают, сколько надо взять вещества для анализа, то есть какую навеску необходимо взять. Этот расчет обязательно должен предшествовать анализу во избежание получения слишком малого или, наоборот, слишком большого количества прокаленного осадка. При слишком малой массе осадка неизбежные потери на всех стадиях анализа, неточность аналитических весов внесут слишком значительную (в долевом отношении) ошибку. Если взять слишком большую навеску, при осаждении получится столь большое количество осадка, что его невозможно будет тщательно промыть. При расчете навески обычно достаточно определить только два первых знака, но само взвешивание, конечно, проводят с обычной аналитической точностью, то есть до четвертого знака. Пример 4. Какую навеску феррованадия, содержащего примерно 0,10–0,15 % (масс.) фосфора, следует взять для точного определения его содержания в сплаве, если фосфор осаждают в виде фосфорномолибденовоаммонийной соли (NH4)3PO4 · 12 MoO3 ·2H2O, которую высушивают и прокаливают до получения P2O5 ·24MoO3? Масса получаемого осадка примерно 0,1 г. Решение Сначала составляем схему анализа: Р → (NH4)3 PO4 · 12 MoO3 ·2H2O → P2O5 ·24MoO3. На ее основе вычисляем фактор пересчета для данного определения:  Для расчета массы фосфора, требуемого для проведения анализа, умножим фактор пересчета на полученную массу гравиметрической формы:
Для расчета массы фосфора, требуемого для проведения анализа, умножим фактор пересчета на полученную массу гравиметрической формы: 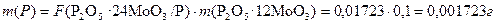 По условию содержание фосфора в сплаве не превышает 0,15 % (масс.).Следовательно, навеска сплава для анализа m сплава вычисляется из пропорции 0,001723 г Р – 0.15% m сплава – 100%. Таким образом, для анализа необходимо взять навеску сплава m сплава = (0,001723 · 100)/0,15 = 1,15 г. 1.4 Расчет результатов анализа Конечной целью проведения гравиметричекого анализа является вычисление массового содержания или массовой доли определяемого вещества. Эти расчеты производятся на основе уравнений реакций образования гравиметрической формы. Пример 5. Определение свинца в руде проводили осаждением его в виде PbSO4. Для этого навеску руды массой 2,2590 г растворили, осадили из подготовленного анализируемого раствора свинец в виде PbSO4. После соответствующей обработки полученный осадок сульфата свинца прокалили и взвесили. Масса осадка PbSO4 составила 0,2547 г. Вычислить массовую долю свинца в руде. Решение В основе определения лежит реакция образования труднорастворимого соединения сульфата свинца при взаимодействии определяемых ионов свинца с ионами сульфата: Pb2+ + SO42- = PbSO4↓. В данном случае составы осаждаемой и гравиметрической формы осадка совпадают. Требуемые для последующих расчетов молярные массы составляют M (PbSO4) = 303 г/моль; M(Pb) = 207 г/моль. Рассчитаем фактор пересчета сульфата свинца на свинец:
По условию содержание фосфора в сплаве не превышает 0,15 % (масс.).Следовательно, навеска сплава для анализа m сплава вычисляется из пропорции 0,001723 г Р – 0.15% m сплава – 100%. Таким образом, для анализа необходимо взять навеску сплава m сплава = (0,001723 · 100)/0,15 = 1,15 г. 1.4 Расчет результатов анализа Конечной целью проведения гравиметричекого анализа является вычисление массового содержания или массовой доли определяемого вещества. Эти расчеты производятся на основе уравнений реакций образования гравиметрической формы. Пример 5. Определение свинца в руде проводили осаждением его в виде PbSO4. Для этого навеску руды массой 2,2590 г растворили, осадили из подготовленного анализируемого раствора свинец в виде PbSO4. После соответствующей обработки полученный осадок сульфата свинца прокалили и взвесили. Масса осадка PbSO4 составила 0,2547 г. Вычислить массовую долю свинца в руде. Решение В основе определения лежит реакция образования труднорастворимого соединения сульфата свинца при взаимодействии определяемых ионов свинца с ионами сульфата: Pb2+ + SO42- = PbSO4↓. В данном случае составы осаждаемой и гравиметрической формы осадка совпадают. Требуемые для последующих расчетов молярные массы составляют M (PbSO4) = 303 г/моль; M(Pb) = 207 г/моль. Рассчитаем фактор пересчета сульфата свинца на свинец: 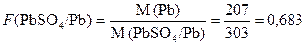 Вычислим массу свинца в полученной гравиметрической форме: m (Pb) = m (PbSO4) · F (PbSO4 ∙ Pb) = 0,2547·0,683 = 0,1740 г. Следовательно, в навеске анализируемой руды массой 2,2590 г содержится 0,1740 г свинца. Теперь можем вычислить массовую долю свинца в анализируемом веществе: 0,1740 г Pb содержится в 2,2590 г анализируемой рудыm г Pb содержится в 100 г анализируемой руды; m (Pb) = ω (Pb) = (0,1740·100) / 2,2590 =7,70 % Pb. Следовательно, массовая доля свинца в исследуемой руде составляет ω (Pb) = 7,70 %. 2 Групповое задание. Решение задач Последовательность оформления решения задачи:1. Полностью переписать условие задачи;2. Записать тип расчета, рассматриваемый в данной задаче;3. Записать схему определения или химические уравнения реакций, лежащих в основе расчетов;4. Привести подробное обоснование решения и необходимые вычисления.
Вычислим массу свинца в полученной гравиметрической форме: m (Pb) = m (PbSO4) · F (PbSO4 ∙ Pb) = 0,2547·0,683 = 0,1740 г. Следовательно, в навеске анализируемой руды массой 2,2590 г содержится 0,1740 г свинца. Теперь можем вычислить массовую долю свинца в анализируемом веществе: 0,1740 г Pb содержится в 2,2590 г анализируемой рудыm г Pb содержится в 100 г анализируемой руды; m (Pb) = ω (Pb) = (0,1740·100) / 2,2590 =7,70 % Pb. Следовательно, массовая доля свинца в исследуемой руде составляет ω (Pb) = 7,70 %. 2 Групповое задание. Решение задач Последовательность оформления решения задачи:1. Полностью переписать условие задачи;2. Записать тип расчета, рассматриваемый в данной задаче;3. Записать схему определения или химические уравнения реакций, лежащих в основе расчетов;4. Привести подробное обоснование решения и необходимые вычисления. Задача № 1. Вычислить фактор пересчета (гравиметрический фактор) в следующих вариантах:
| Вариант | 1 | 2 | 3 |
| Определяемое вещество | Bi | K3PO4 | Mg |
| Гравиметрическая форма | Bi2O3 | K2PtCl6 | Mg2P2O7 |
Задача № 2. Навеску алюминиевого сплава массой 0,1425 г растворили в колбе вместительностью 200,0 мл. Из 20,0 мл этого раствора получил осадок оксихинолината алюминия Al(C9H6ON)3 массой 0,2012 г. Вычислить массовую долю (%) алюминия в сплаве.
Задача № 3. Вычислить число молекул воды в кристаллогидрате хлорида магния, если из навески его массой 0,5 г получили 0,2738 г Mg2P2O7.
Задача № 4. Рассчитать массу навески апатито-нефелиновой руды, содержащей около 30 % P2О5, необходимую для получения 0,9 г осадка (NH4)3PO4∙12MoO3.
Задача № 5. Из навески каменного угля массой 2,6248 г после соответствующей обработки получили 0,3248 г BaSO4. Вычислить массовую долю (%) серы в каменном угле. Пересчитать массовую долю серы на сухое вещество, если содержание влаги составило 2,58 %.
Задача № 6. При определении оксидов щелочных металлов из образца силикатной породы массой 1,2505 г выделили смесь NaCl и KCl массой 0,15 г. После многократной обработки этой смеси серной кислотой получили сульфаты Na2SO4 и K2SO4 массой 0,18 г. Вычислить массовые доли (%) Na2O и K2O в силикатной породе.
Раздел 5. Титриметрические методы анализа и их применение для контроля качества товаров
|
|
|
|
|
Дата добавления: 2014-12-26; Просмотров: 3839; Нарушение авторских прав?; Мы поможем в написании вашей работы!