
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И необратимых процессах
|
|
|
|
Из математики известно, что если интеграл по замкнутому контуру равен нулю, то подинтегральное выражение представляет собой полный дифференциал некоторой функции. Для подинтегральной функции из (3.12) введем следующее обозначение:
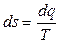 . (3.16)
. (3.16)
Тогда для обратимого кругового процесса можно записать:
 . (3.17)
. (3.17)
Функция s, полный дифференциал которой равен 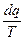 (dq – теплота в обратимом процессе), называется энтропией.
(dq – теплота в обратимом процессе), называется энтропией.
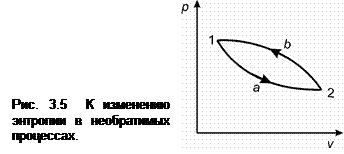
Очевидно, что величина интеграла 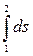 , определенная для любого обратимого процесса перехода вещества из состояния 1 в состояние 2 (рис. 3.5), представляет собой изменение энтропии рабочего тела в рассматриваемом процессе. Изменение энтропии не зависит от пути процесса, а зависит только от параметров рабочего тела в начальном и конечном состоянии. Действительно:
, определенная для любого обратимого процесса перехода вещества из состояния 1 в состояние 2 (рис. 3.5), представляет собой изменение энтропии рабочего тела в рассматриваемом процессе. Изменение энтропии не зависит от пути процесса, а зависит только от параметров рабочего тела в начальном и конечном состоянии. Действительно:
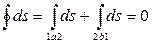 ,
,
но так как:
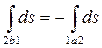 ,
,
то, следовательно:
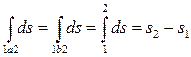 (3.18)
(3.18)
Таким образом, энтропия является функцией состояния, величина которой однозначно определяется параметрами состояния. Отметим, что через s обозначается удельная энтропия, т.е. энтропия, отнесенная к 1 кг вещества 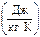 ; а энтропия, отнесенная к произвольному количеству вещества, обозначается через
; а энтропия, отнесенная к произвольному количеству вещества, обозначается через 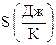 .
.
Если в термодинамическую систему входит несколько тел, энтропии которых равны S 1, S 2, …, S n, то энтропия системы в равна:
S сист = S 1+ S 2 +… + S n (3.19)
Из (3.16) следует, что энтропия отдельного тела или системы тел в обратимых термодинамических процессах может как возрастать, так и уменьшаться. Так как абсолютная температура Т всегда положительна, то подводу теплоты к телу или системе тел (dq > 0) соответствует возрастание энтропии (ds > 0), а отводу теплоты (dq <0) - уменьшение энтропии (ds < 0).
Определим величину энтропии какого-либо вещества путем интегрирования выражения (3.16):
 , (3.20)
, (3.20)
где s 0 – постоянная интегрирования.
В термодинамических расчетах определяется не абсолютное значение энтропии, а ее изменение Δ s в процессе, определяемое по уравнениям (3.18). Из (3.19) следует, что изменение энтропии термодинамической системы определяется как алгебраическая сумма изменений энтропии всех тел, входящих в систему. Тогда
Δ S сист = Δ S 1 + Δ S 2 + … + Δ S n. (3.21)
Выведем уравнения для определения изменения энтропии в процессах с идеальными газами. Подставив в (3.16) величину dq из (2.13), получим:
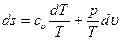 . (3.22)
. (3.22)
Поскольку для идеального газа
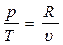 , (3.23)
, (3.23)
то:
 . (3.24)
. (3.24)
Интегрирование (3.24) при постоянной теплоемкости cυ позволяет получить:
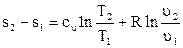 . (3.25)
. (3.25)
Из уравнения состояния для идеального газа следует:
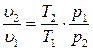 (3.26)
(3.26)
Подставив (3.26) в (3.25), после простых преобразований получим:
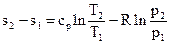 . (3.27)
. (3.27)
Уравнения (3.25) и (3.27) позволяют определить изменения энтропии в обратимом термодинамическом процессе идеального газа, если известны параметры состояния газа в исходной и конечной точках процесса.
Рассмотрим особенности изменения энтропии в необратимых процессах. Пусть рабочее тело переходит из состояния 1 (рис. 3.5) в состояние 2 произвольным необратимым процессом 1-а-2 и затем возвращается в исходное состояние обратимым процессом 2-b-1. Очевидно, что цикл 1-а-2-b-1 является необратимым и для него справедливо неравенство
 , или
, или 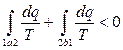 .
.
Интеграл 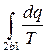 , взятый по обратимому процессу 2-b-1, в соответствии с (3.18) равен разности энтропий s1 – s2. Тогда:
, взятый по обратимому процессу 2-b-1, в соответствии с (3.18) равен разности энтропий s1 – s2. Тогда:
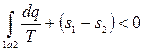 , или
, или
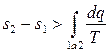 (3.28)
(3.28)
Таким образом, в необратимых процессах изменение энтропии всегда больше интегральной суммы приведенных теплот данного процесса.
В дифференциальной форме уравнение (3.28) имеет вид:
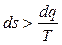 . (3.29)
. (3.29)
Соотношения (3.16) и (3.29) можно объединить в одно выражение:
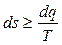 , (3.30)
, (3.30)
где знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
Выражение (3.30) рассматривается как аналитическая запись второго закона термодинамики.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 871; Нарушение авторских прав?; Мы поможем в написании вашей работы!