
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия изолированной системы
|
|
|
|
Поскольку для изолированной (адиабатной) системы с обратимыми процессами dQ = 0, то в соответствии с (3.30) можно записать:
dS = 0. (3.31)
Отсюда следует, что энтропия изолированной системы, в которой протекают только обратимые процессы, остается постоянной (S 2 = S 1 = const).
Энтропия изолированной системы будет возрастать, если в ней имеют место необратимые процессы:
dS > 0; S 2 > S 1.
Как известно, все самопроизвольные процессы являются необратимыми. Если изолированная термодинамическая система находится в начальном неравновесном состоянии, то внутри нее будут протекать самопроизвольные процессы обмена энергией между отдельными телами до тех пор, пока система в целом не придет в равновесное состояние. При этом энтропия отдельных тел, входящих в систему, может увеличиваться или уменьшаться, в зависимости от того, подводится к ним теплота или отводится. Но энтропия изолированной системы при этом будет только возрастать.
Рассмотрим изолированную систему, состоящую из двух тел с температурой первого тела Т 1 и второго - Т 2. Будем считать Т 1 > Т 2, тогда теплота будет самопроизвольно переходить от горячего тела к холодному. Если от первого тела ко второму перешло количество теплоты Q, то при постоянных Т 1 и Т 2 энтропия первого уменьшится на величину:
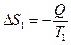 , (3.32)
, (3.32)
а второго возрастет на величину:
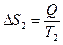 . (3.33)
. (3.33)
Изменение энтропии системы будет равно:
ΔSсист. = 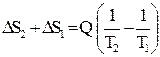 .
.
Так как Т 2 < Т 1, то Δ S сист. > 0. Очевидно, чем больше разница температур Т 1 и Т 2, тем сильнее проявляется необратимость процесса, протекающего в системе, и тем больше возрастает ее энтропия. Нетрудно показать, что и для других необратимых процессов, протекающих в изолированной системе, энтропия системы возрастает (п. 2.11). Сказанное позволяет рассматривать энтропию как величину, характеризующую меру необратимости процессов, протекающих в изолированной системе.
При достижении равновесного состояния в изолированной системе ее энтропия возрастает до максимального значения. Равновесная система не способна к производству работы, хотя она располагает тем же запасом энергии, что и в начальном неравновесном состоянии. Равновесная термодинамическая система как источник работы мертва.
Больцман нашел связь между энтропией системы и термодинамической вероятностью ω, которая представляет собой число способов, которыми может быть осуществлено конкретное равновесное состояние. Эта связь имеет следующий вид Sсист. = к · lnω, где к = 1,38 10-23 Дж/К – постоянная Больцмана.
Положение о возрастании энтропии изолированной системы было впервые сформулировано Р. Клаузиусом. Однако, он распространил его на всю Вселенную, обобщив первый и второй законы термодинамики в следующей формулировке: «Энергия мира постоянна, энтропия мира стремится к максимуму». Эта формулировка дала основание ученым-идеалистам рассматривать Вселенную как термодинамическую систему, где процессы обмена энергией протекают односторонне и с течением времени должны привести ее в равновесное состояние, когда прекратятся все процессы, в том числе и жизненные. Это состояние получило наименование «тепловой смерти» Вселенной. Ошибочность концепции Клазиуса состоит в том, что Вселенную нельзя рассматривать как конечную изолированную систему. В космосе протекают и другие процессы, которые не подчиняются законам термодинамики конечных систем.
Утверждение о возможности «тепловой смерти» Вселенной приводит к выводу о существовании в прошлом некоторого исходного состояния, т.е. возникновения Вселенной. Эти утверждения о начале и конце окружающего нас мира противоречат современному учению о природе. Законы и выводы, полученные для ограниченных изолированных систем в условиях Земли, нельзя произвольно распространять на всю Вселенную.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 7684; Нарушение авторских прав?; Мы поможем в написании вашей работы!