
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Давление света. Фотон – элементарная частица, которая всегда (в любой среде!) движется со скоростью света c и имеет массу покоя
|
|
|
|
Масса фотона:

Фотон – элементарная частица, которая всегда (в любой среде!) движется со скоростью света c и имеет массу покоя, равную нулю. Следовательно, масса фотона отличается от массы таких элементарных частиц, как электрон, протон и нейтрон, которые обладают отличной от нуля массой покоя и могут находиться в состоянии покоя.
Импульс фотона:

Если фотоны обладают импульсом, то свет, падающий на тело, должен оказывать на него давление. Согласно квантовой теории, давление света на поверхность обусловлено тем, что каждый фотон при соударении с поверхностью передает ей свой импульс.
Если в единицу времени на единицу площади поверхности тела падает N фотонов, то при коэффициенте отражения ρ света от поверхности тела ρN фотонов отразится, а (1-ρ) – поглотится. Каждый поглощенный фотон передает поверхности импульс  , а каждый отраженный -
, а каждый отраженный -  (при отражении импульс фотона изменяется на -
(при отражении импульс фотона изменяется на -  ). Давление света на поверхность равно импульсу, который передают поверхности в 1 с N фотонов:
). Давление света на поверхность равно импульсу, который передают поверхности в 1 с N фотонов:

Nhv=Ee есть энергия всех фотонов, падающих на единицу поверхности в единицу времени, т.е. энергетическая освещенность поверхности, а а Ee/c=w – объемная плотность энергии излучения. Поэтому давление, производимое светом при нормальном падении на поверхность,

Элементы квантовой физики. Модели атома Томсона и Резерфорда. Линейчатый спектр атома водорода. Постулаты Бора. Спектр атома водорода по Бору
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж.Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871-1937) по рассеянию α-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2 e и массой, примерно в 7300 раз большей массы электрона. Пучки α-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость (порядка 107 м/с)).
Резерфорд, исследуя прохождение α-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые α-частицы (примерно одна из 20000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180о). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как α-частицы, то Резерфордом был сделан вывод, что значительное отклонение α-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие α-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома.
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z – порядковый номер элемента в системе Менделеева, e – элементарный заряд), размер 10-15 – 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра должно вращаться Z электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид

где me и v – масса и скорость электрона на орбите радиуса r, ε0 – электрическая постоянная.
Уравнение содержит два неизвестных: r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, v (следовательно, и E) могут меняться непрерывно, т.е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Из выражения следует, что при r≈10-10 м скорость движения электронов v ≈106 м/с, а ускорение v2/r=1022 м/с2. Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой – квантовой - теории атома.
Исследования спектров разряженных газов (т.е. спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома – атома водорода.
Швейцарский ученый И. Бальмер (1825-1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:

где 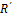 - постоянная Ридберга. Так как v=c/λ, то формула может быть переписана для частот
- постоянная Ридберга. Так как v=c/λ, то формула может быть переписана для частот

где R=R’c=3,29*1015 c-1 – также постоянная Ридберга.
Из этих выражений вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение n=∞ определяет границу серии, к которой со стороны бОльших частот примыкает сплошной спектр. В дальнейшем (в начале XX века) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:

В инфракрасной области спектра были также обнаружены:
серия Пашена

серия Брэкета

серия Пфунда

серия Хэмфри

Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:

где m имеет в каждой данной серии постоянное значение, m=1,2,3,4,5,6 (определяет серию), n принимает целочисленные значения начиная с m+1 (определяет отдельные линии этой серии).
Постулаты Бора:
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
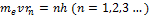
где  – масса электрона,
– масса электрона,  – его скорость по n-й орбите радиуса
– его скорость по n-й орбите радиуса  , h=h/(2π).
, h=h/(2π).
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией

равной разности энергий соответствующих стационарных состояний (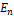 и
и  – соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Em<En происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при
– соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Em<En происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при  >
> 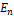 – его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ν=(
– его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ν=(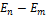 ) /h квантовых переходов и определяет линейчатый спектр атома.
) /h квантовых переходов и определяет линейчатый спектр атома.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (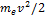 ) и потенциальной энергии в электростатическом поле ядра (-Ze2/(4πε0r)):
) и потенциальной энергии в электростатическом поле ядра (-Ze2/(4πε0r)):


Спектр поглощения атома водорода является линейчатым, но содержит при нормальных условиях только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n=1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана).
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой – основывается на квантовых постулатах). В теории Бора рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, однако эта теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с её помощью спектра атома гелия – одного из простейших атомов, непосредственно следующего за атомом водорода.
Элементы квантовой механики. Корпускулярно — волновой дуализм свойств вещества. Свойства волн де Бройля. Соотношение неопределенностей Гейзенберга. Волновая функция и ее статистический смысл. Общее уравнение Шредингера
Корпускулярно-волновой дуализм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства.
Французский ученый Луи де Бройль (1892—1987), осознавая существующую в природе симметрию и развивая представления о двойственной корпускулярно-волновой природе света, выдвинул в 1923 году гипотезу об универсальности корпускулярно-волнового дуализма. Он утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики — энергия  и импульс
и импульс 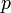 , а с другой стороны — волновые характеристики — частота и длина волны.
, а с другой стороны — волновые характеристики — частота и длина волны.
Такие явления, как интерференция и дифракция света, убедительно свидетельствуют о волновой природе света. В то же время закономерности равновесного теплового излучения, фотоэффекта и эффекта Комптона можно успешно истолковать с классической точки зрения только на основе представлений о свете, как о потоке дискретных фотонов. Однако волновой и корпускулярный способы описания света не противоречат, а взаимно дополняют друг друга, так как свет одновременно обладает и волновыми и корпускулярными свойствами.
Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу.
В 1924 году французский физик Луи де Бройль высказал гипотезу о том, что установленный ранее для фотонов корпускулярно-волновой дуализм присущ всем частицам — электронам, протонам, атомам и так далее, причём количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и для фотонов. Таким образом, если частица имеет энергию  и импульс, абсолютное значение которого равно
и импульс, абсолютное значение которого равно 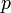 , то с ней связана волна, частота которой
, то с ней связана волна, частота которой 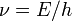 и длина волны
и длина волны  , где
, где 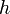 — постоянная Планка. Эти волны и получили название волн де Бройля.
— постоянная Планка. Эти волны и получили название волн де Бройля.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 924; Нарушение авторских прав?; Мы поможем в написании вашей работы!