
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение первого начала термодинамики
|
|
|
|
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V =const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1 — 3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.  из первого начала термодинамики (Q= d U+A)дляизохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
из первого начала термодинамики (Q= d U+A)дляизохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: 
 Тогда для произвольной массы газа получим
Тогда для произвольной массы газа получим 
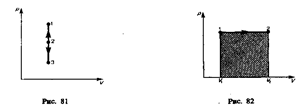
Изобарный процесс (p =const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа (см. (52.2)) при увеличения объема от V 1 до V 2 равна 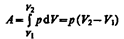
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение Клапейрона — Менделеева для выбранных нами двух состояний, то 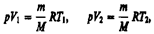 откуда
откуда 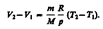
Тогда выражение для работы изобарного расширения примет вид 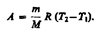
Из этого выражения вытекает физический смысл молярной газовой постоянной R:если T 2 — T 1 =1 К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты 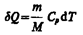
его внутренняя энергия возрастает на величину 
Изотермический процесс (T =const). Как уже указывалось, изотермический процесс описывается законом Бойля—Мариотта: 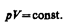
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
найдем работу изотермического расширения газа: 
Так как при Т =const внутренняя энергия идеального газа не изменяется: 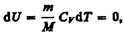
то из первого начала термодинамики (Q= d U+A) следует, что для изотермического процесс  т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил: 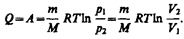

Адиабатическим называется процесс, при котором отсутствует теплообмен (Q= 0)между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.Из первого начала термодинамики (Q= d U+A) для адиабатического процесса следует, что 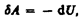 т. е. внешняя работа совершается за счет изменения внутренней энергии системы
т. е. внешняя работа совершается за счет изменения внутренней энергии системы 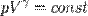 …
… 
 -уравнения адиабат. Процесса.
-уравнения адиабат. Процесса.  называется показателем адиабаты (или коэффициентом Пуассона). Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и С p, в изотермическом процессе (d T=0) теплоемкость равна ±, в адиабатическом (Q =0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называется политропным.
называется показателем адиабаты (или коэффициентом Пуассона). Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и С p, в изотермическом процессе (d T=0) теплоемкость равна ±, в адиабатическом (Q =0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называется политропным.
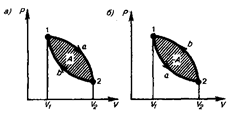
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис. 84). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1 — 2) и сжатия (2 — 1) газа. Работа расширения (определяется площадью фигуры 1a2V 2 V 1 1) положительна (d V >0), работа сжатия (определяется площадью фигуры 2b1V 1 V 2 2) отрицательна (d V< 0 ). Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A= 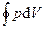 > 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа A=
> 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа A= 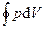 < 0 (цикл протекает против часовой стрелки), то он называется обратным (рис. 84, б).
< 0 (цикл протекает против часовой стрелки), то он называется обратным (рис. 84, б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса  т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому
т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому 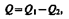 где Q 1 — количество теплоты, полученное системой, Q 2 — количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса
где Q 1 — количество теплоты, полученное системой, Q 2 — количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса 
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среда и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что се любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично», идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д.), которая нами не обсуждается. Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум причинам: 1) многие процессы в природе и технике практически обратимы; 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно Q/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю: 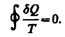 (57.1)
(57.1)
Из равенства нулю интеграла (57.1), взятого по замкнутому контуру, следует, что подынтегральное выражение Q/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,  (57.2) Функция состояния, дифференциалом которой является Q/T, называется энтропией и обозначается S. Из формулы (57.1) следует, что для обратимых процессов изменение энтропии
(57.2) Функция состояния, дифференциалом которой является Q/T, называется энтропией и обозначается S. Из формулы (57.1) следует, что для обратимых процессов изменение энтропии 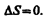 (57.3)В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
(57.3)В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает: 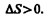
Таккак реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
Работа газа теплоемкость Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d l, то производит над ним работу 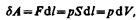
где S — площадь поршня, S d l=dV— изменение объема системы. Таким образом,  (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием формулы (52.1):  (52.2)Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
(52.2)Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:  Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг К)). Молярная теплоемкость —величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг К)). Молярная теплоемкость —величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:  (53.1)где = m / М — количество вещества.
(53.1)где = m / М — количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль К)). Удельная теплоемкость с связана с молярной С m, соотношением 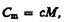 (53.2)
(53.2)
где М — молярная масса вещества.Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (51.2) для 1 моль газа с учетом формул (52.1) и (53.1): 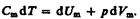 (53.3)Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота вдет только на увеличение его внутренней энергии:
(53.3)Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота вдет только на увеличение его внутренней энергии:  (53.4)т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Согласно формуле (50.1),
(53.4)т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Согласно формуле (50.1),  тогда
тогда  (53.5)Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде
(53.5)Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде  Учитывая, что
Учитывая, что  не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p =const), получаем
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p =const), получаем  (53.6)Выражение (53.6) называется уравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, таккак постоянство давления обеспечивается увеличением объема газа. Использовав (53.5), выражение (53.6) можно записать в виде
(53.6)Выражение (53.6) называется уравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, таккак постоянство давления обеспечивается увеличением объема газа. Использовав (53.5), выражение (53.6) можно записать в виде 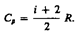
Второе начало термодинамики
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Укажем еще две формулировки второго начала термодинамики:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Первые два начала термодинамики дают недостаточно сведений о поведении термодинамических систем при нуле Кельвина. Они дополняются третьим началом термодинамика, или теоремой Нернста* — Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина: 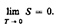
Тепловые двигатели и холодильные машины.
Из формулировки второго начала термодинамики по Кельвину следует, что вечный двигатель второго рода — периодически действующий двигатель, совершающий работу за счет охлаждения одного источника теплоты, — невозможен. Для иллюстрации этого положения рассмотрим работу теплового двигателя (исторически второе начало термодинамики и возникло из анализа работы тепловых двигателей).
Принцип действия теплового двигателя приведен на рис. 85. От термостата* с более высокой температурой Т 1, называемого нагревателем, за цикл отнимается количество теплоты Q 1, а термостату с более низкой температурой Т 2, называемому холодильником, за цикл передается количество теплоты Q 2, при этом совершается работа А = Q 1 – Q 2.
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представлен на рис. 86. Системой за цикл от термостата с более низкой температурой Т 2 отнимается количество теплоты Q 2 и отдается термостату с более высокой температурой Т 1 количество теплоты Q 1. Для кругового процесса, согласно (56.1), Q=A, но, по условию, Q = Q 2 – Q 1< 0, поэтому А< 0 и Q 2 – Q 1= –А, или Q 1 = Q 2 + A, т. е. количество теплоты Q 1, отданное системой источнику теплоты при более высокой температуре T 1 больше количества теплоты Q 2, полученного от источника теплоты при более низкой температуре T 2, на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому. Это утверждение есть не что иное, как второе начало термодинамики в формулировке Клаузиуса.
Основываясь на втором начале термодинамики, Карно вывел теорему, носящую теперь его имя: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T 1) и холодильников (T 2), наибольшим к. п. д. обладают обратимые машины; при этом к. п. д. обратимых машин, работающих при одинаковых температурах нагревателей (T 1) и холодильников (T 2), равны друг другу и не зависят от природы рабочего тела (тела, совершающего круговой процесс и обменивающегося энергией с другими телами), а определяются только температурами нагревателя и холодильника.
Карно теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Цикл Карно изображен на рис. 87, где изотермические расширение и сжатие заданы соответственно кривыми 1 — 2 и 3—4, а адиабатические расширение и сжатие — кривыми 2 — 3 и 4—1. При изотермическом процессе U= const, поэтому, согласно (54.4), количество теплоты Q 1, полученное газом от нагревателя, равно работе расширения А 12, совершаемой газом при переходе из состояния 1 в состояние 2:
 (59.1)
(59.1)
При адиабатическом расширении 2 — 3 теплообмен с окружающей средой отсутствует и работа расширения А 23 совершается за счет изменения внутренней энергии (см. (55.1) и (55.8)):
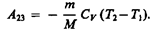

Количество теплоты Q 2, отданное газом холодильнику при изотермическом сжатии, равно работе сжатия А 34:
 (59.2)
(59.2)
Работа адиабатического сжатия

Работа, совершаемая в результате кругового процесса,
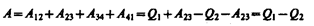
и, как можно показать, определяется площадью, заштрихованной на рис. 87. Термический к. п. д. цикла Карно, согласно (56.2),

Применив уравнение (55.5) для адиабат 2 — 3 и 4—1, получим

откуда
 (59.3)
(59.3)
Подставляя (59.1) и (59.2) в формулу (56.2) и учитывая (59.3), получаем
 (59.4)
(59.4)
Согласно теореме Карно, химический состав рабочего тела не влияет на результаты сравнения температур, поэтому такая термодинамическая шкала не связана со свойствами какого-то определенного термометрического тела. Отметим, что практически таким образом сравнивать температуры трудно, так как реальные термодинамические процессы, как ухе указывалось, являются необратимыми.
Идеальные газы
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 1 м3 газа при нормальных условиях содержится 2,681025 молекул, занимающих объем примерно 10–4 м3 (радиус молекулы примерно 10–10 м), которым по сравнению с объемом газа (1 м3) можно пренебречь. При давлении 500 МПа (1 атм = 101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотрении реальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона — Менделеева (42.4) pV m =RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не V m, а V m — b, где b — объем,занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е. 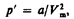 (где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, V m — молярный объем.Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
(где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, V m — молярный объем.Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов): 
Волновые процессы. Продольные и поперечные волны. Длина волны, скорость, частота (связь между этими величинами). Уравнение бегущей волны. Уравнение стоячей волны. Интерференция волн. Электромагнитные волны
Волновые процессы. Продольные и поперечные волны. Длина волны, скорость, частота (связь между этими величинами). Колебания, возбужденные в какой-либо точке среды (твердой, жидкой или газообразной), распространяются в ней с конечной скоростью, зависящей от свойств среды, передаваясь от одной точки среды к другой. Чем дальше расположена частица среды от источника колебаний, тем позднее она начнет колебаться. Иначе говоря, фазы колебаний частиц среды и источника тем больше отличаются друг от друга, чем больше это расстояние. При изучении распространения колебаний не учитывается дискретное (молекулярное) строение среды и среда рассматривается как сплошная, т. е. непрерывно распределенная в пространстве и обладающая упругими свойствами. Процесс распространения колебаний в сплошной среде называется волновым процессом (или волной). При распространении волны частицы среды не движутся вместе с волной, а колеблются около своих положений равновесия. Вместе с волной от частицы к частице среды передаются лишь состояние колебательного движения и его энергия. Поэтому основным свойством всех волн, независимо от их природы, является перенос энергии без переноса вещества. Среди разнообразных волн, встречающихся в природе и технике, выделяются следующие их типы: волны на поверхности жидкости, упругие и электромагнитные волны. Упругими (или механическими) волнами называются механические возмущения, распространяющиеся в упругой среде. Упругие волны бывают продольные и поперечные. В продольных волнах частицы среды колеблются в направлении распространения волны, в поперечных — в плоскостях, перпендикулярных направлению распространения волны. Продольные волны могут возбуждаться в средах, в которых возникают упругие силы при деформации сжатия и растяжения, т. е. твердых, жидких и газообразных телах. Поперечные волны могут возбуждаться в среде, в которой возникают упругие силы при деформации сдвига, т. е. в твердых телах; в жидкостях и газах возникают только продольные волны, а в твердых телах — как продольные, так и поперечные. Упругая волна называется гармонической, если соответствующие ей колебания частиц среды являются гармоническими. Расстояние между ближайшими частицами, колеблющимися в одинаковой фазе, называется длиной волны l. Длина волны равна тому расстоянию, на которое распространяется определенная фаза колебания за период.  или, учитывая, что T = 1/ n, где n — частота колебаний,
или, учитывая, что T = 1/ n, где n — частота колебаний, 

Уравнение бегущей волны. Бегущими волнами называются волны, которые переносят в пространстве энергию. Перенос энергии волнами количественно характеризуется вектором плотности потока энергии. Этот вектор для упругих волн называется вектором Умова. Направление вектора Умова совпадает с направлением переноса энергии, а его модуль равен энергии, переносимой волной за единицу времени через единичную площадку, расположенную перпендикулярно направлению распространения волны. Для вывода уравнения бегущей волны — зависимости смещения колеблющейся частицы от координат и времени — рассмотрим плоскую волну, предполагая, что колебания носят гармонический характер, а ось х совпадает с направлением распространения волны. В данном случае волновые поверхности перпендикулярны оси х, а так как все точки волновой поверхности колеблются одинаково, то смещение x будет зависеть только от x и t, т. е. x = x (x, t). Если колебания точек, лежащих в плоскости х= 0,описываются функцией x (0, t) = A cos wt, то частица В среды колеблется по тому же закону, но ее колебания будут отставать по времени от колебаний источника на t, так как для прохождения волной расстояния х требуется время t = x / v, где v — скорость распространения волны. Тогда уравнение колебаний частиц, лежащих в плоскости х, имеет вид  . Уравнение есть уравнение бегущей волны.
. Уравнение есть уравнение бегущей волны.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1560; Нарушение авторских прав?; Мы поможем в написании вашей работы!