
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи курса химии средней школы
|
|
|
|
Прежде чем решать вопрос о том как и чему учить,надо определить цели и задачи обучения.
Цели-предполагаемый результат обучения,на достижение которого будет направлена совместная деятельность учителя и учащихся в процессе изучения химии.
Образовательные задачи:
Образовательные задачи вытекают из соответствующих целей. Их последовательное решение приводит к овладению знаниями и умениями.
1) Ведущими знаниями являются теории, законы, идеи. Усвоение этого материала-главная общеобразовательная задача обучения химии;
2) Усвоение необходимою фактологического материала, установление связи между теорией и фактами, а их с жизнью;
3) Формирование, развитие и интеграция понятий в теоретические системы знаний;
4)Овладение химической терминологией, номенклатурой и символикой;
5) Усвоение методологических знаний;
6)Выработка умений и навыков, развитие опыта творческой деятельности;
7) Установление внутрипредметных и межпредметных связей в процессе изучения химии;
Воспитательные задачи:
1) Формирование научного мировоззрения учащихся
Мировоззрение-система взглядов человека на мир в целом,на место в нем,состовляющие осознанные убеждения его отношений к окружающему миру.
Химия как учебный предмет уже формирует научное мировоззрение учащихся,т.к. они работают с веществами,наблюдают превращения веществ,убеждаются в объективности существования веществ и их свойств,в позноваемости окружающего мира,в материальном единстве мира.
2) Задача политехнизации знаний-показ роли химии в организации материальной и духовной жизни людей:
-изучение химических производств в школе
-изучение вопросов получения и применения веществ
-профориентация учащихся
3) Нравственное воспитание
Развивающие задачи:
-формирование интереса к предмету
-развитие приемов анализа, сравнения и обобщения
-развитие мышления, воли и памяти
-развитие самостоятельности мышления
66. Скорости хим. р-й. Факторы, влияющие на скорость хим. р-й. Классиф. хим. р-й. Молекулярность и порядок р-и. Энергия активации.
Классификация 1:
1. гомогенные(газы, жидкости)- система однородная.
2. гетерогенные- исх.в-ва наход в разных агрегатных состояниях, а р-я идет на пов-ти раздела фаз (горение угля).
скорость гомогенной р-и = изменению конц в-ва за ед. времени (υгом=ΔС\Δτ)
скорость гетерогенной р-и (υгетер=Δn\SΔτ), где S-поверхность раздела фаз.
Скорость гомогенной реакции зависит от:
1. Природы реагирующих в-в. 2. От концентрации. 3. От температуры при изменении температуры на 10 градусов скорость р-и возрастает в 2-4 раза. 4. От присутствия катализаторов. 5. От агрегатного состояния исх. в-в. (в газовой фазе идут быстрее, чем в жидкой). 6. От природы растворителя 7. Если р-я идет в тверд. фазе, то от степени измельчения.
Классификация 2:
1. По молекулярности. бывают одно, би, параллельные.(О2=2О; Н2+I2=2НI; 3H2 + N2 = 2NH3.)
2. По порядку реакции. Порядок реакции- сумма показателей степеней концентрации исходных веществю. Н2+Br2=2НВr υ=кC1Н2∙СВr2 n=1+1=2.
Порядок и молекулярность совпадают только для простых р-й.
Классификация 3:
1. Простые р-и (т.е р-и состоящие из одной стадии.)
2. Сложные р-и(сост. из нескольк. стадий), сюда относ обратимые, параллельные, цепные р-и.
Цепные р-и – это р-и облад энергией, которая сама собой в системе не возникает, для того что бы она возникла необходима, что бы система извне получила энергию.
3 стадии цепной р-и: 1. Заряжение цепи. 2.Развертывание цепи. 3. Обрыв цепи.
Н2 + Сl2=2НСl.
1 – я стадия Сl2 + hυ=Cl* + Cl Сl2 + Na=NaCl + Cl*
2 – я стадия Cl* +Н2 = НСl +H* H* + Сl2 = НСl + Cl*
3 – я стадия H* + H* = Н2
Скорость цепной р-и зависит: природы исх.в-в, концентр, от кол-ва поглощенной светов. энергии, от Р, от Т, от размера сосуда, где идет р-я, от формы сосуда, от наличия примесей.
Фотохимические р-и – протекающие под воздействием света (фотосинтез)
Энергия активации – избыточная энергия активной молекулы, благодаря которой становится возможной химическая р-я. Выражается в кал/моль.
Энргия актив. зависит от строения молекулы, и от того в какую р-ю вступает мол-ла.
67. Алканы Ациклические имеют формулу CnH2n+2. номенклатура по самой длинной цепи.
Строение углерод имеет тетраэдрическое строение, преимущественно является трансоидная заторможенная конформация, т.к. маетилье группы и аотмы водорода наиболее удалены (пространственное взаимодействие между ними минимально) и минимальна Ер
Возможна только изомерия цепи. Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью.
Синтез.
1. Из непредельных соединений: R-CH=CH2 R-CH2-CH3
R-C=CH R-CH2-CH3
2. Из галогеналканов и спиртов: есть немногочисленные методы прямого восстановления алканов
2R-Br + 2Na R-R + 2NaBr
Физические свойства: С1 – С4 – газы, С5 – С15 – жидкости, С16 – Сn – твердые вещества.
С увеличением молекулярной массы увеличивается t плавления, tкипения, плотность
Химические свойства
Реакции замещения: R-H + · X R-X + · H
характерны реакции радикального замещения – галогенирование (практическое значение имеет взаимодействие с хлором и бромом, при этом бром более селективный, а хлор более активный. Фтор реагирует с алканами слишком активно, со взрывом, образуя смесь продуктов фторирования. Выход: а)разбавленные в инертном газе растворы фтора,
б) CoF3 → CoF2 + (F2)
Йод не реагирует вообще.
СН4 → СH3Cl + HCl
CH4 → CH3Br + HBr
Механизм реакции галогенирования:
1. Cl2 → 2 Cl · инициирование
2. H3C-H + · Cl → H3C · + H-Cl зарождение цепи
3. H3C · + Cl-Cl → CH3Cl + Cl · рост цепи
4. обрыв цепи Cl · + · CH3 → CH3Cl или CH3 · + · CH3 → C2H6
Разработан в 30-е годы Семеновым
Региоселективность галогенирования. В случае субстрата подходящего строения преимущественно образуются более замещенные галогеналканы. При этом бромирование более селективный процесс. Селективность процесса определяется двумя факторами: икнетическим – скорость отрыва атомов того или иного вида, статическим – количество атомов того или иного вида.
Нитрование (реакция Коновалова)
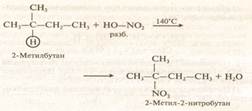
Сульфирование
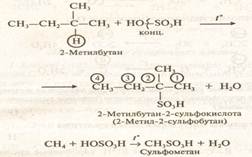
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 981; Нарушение авторских прав?; Мы поможем в написании вашей работы!