
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сущность и виды электролитических процессов
|
|
|
|
ЭЛЕКТРОЛИТИЧЕСКИЕ ПОКРЫТИЯ
Электролитическое (гальванические) покрытия широко применяют при восстановлении изношенных деталей [2,4,32-36]. По сравнению с наплавкой они имеют ряд преимуществ:
- отсутствие термического воздействия на основной металл;
- возможность наращивания осадка в узких пределах по толщине, что позволяет сократить последующую механическую обработку;
- возможность одновременного восстановления большого количества деталей и автоматизировать процесс.
В основу процесса положен электролиз металлов, сущность которого заключается в следующем. При прохождении постоянного тока через электроды, опущенные в электролит (раствор), в последнем образуются положительно и отрицательно заряженные ионы. Ионы, несущие положительный заряд перемещаются к отрицательному электроду — катоду, а ионы, несущие отрицательный заряд, направляются к положительному электроду — аноду, на которые они передают свои заряды. На аноде происходит растворение металла (переход его в раствор) с выделением кислорода, а на катоде — отложение металла с выделением водорода.
Процесс электролитического осаждения подчиняется законам Фарадея:
– количество выделившегося при электролизе вещества прямо пропорционально силе тока и времени его прохождения;
– количество масс различных веществ, образовавшихся на электродах при действии одного и того же количества электричества, пропорциональны их эквивалентным массам.
Эквивалентная масса представляет собой атомный вес элемента или молекулярный вес вещества, деленный на валентность. Эквивалентная масса, выраженная в граммах, называется грамм—эквивалентом. Чтобы выделить 1 г.-экв. любого вещества, необходимо пропустить через электролит 26,8 А×ч или 96494 Кулона электричества (константа Фарадея). Если разделить эквивалентную массу любого вещества на 26,8, то получим число граммов данного металла, выделившегося на катоде или растворяющегося на аноде при пропускании через электролит 1 А×ч. Это число называется электрохимическим эквивалентом данного металла.
Рассеивающей способностью электролита называется величина, характеризующая свойство электролита давать по толщине равномерные покрытия на катодах сложной формы.
Теоретическое количество металла, выделившегося на катоде, определяется по формуле
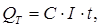
| (5.1) |
где С – электрохимический эквивалент выделяющегося на катоде вещества, г/А×ч (для хрома С = 0,323; для железа С = 1,043; для никеля С = 1,095); I – ток, А; t – продолжительность электролиза, ч.
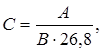
| (5.2) |
где А – атомный вес; В – валентность.
Но так как одновременно с осаждением на катоде металла выделяется водород и могут протекать другие процессы, то фактически осажденного металла будет меньше от теоретически возможного. Отношение практически полученной величины выхода металла (Q Ф) к теоретически вычисленной (Q Т) называется выходом по току (h) в процентах

| (5.3) |
Продолжительность электролиза t, часов, определяется по формуле
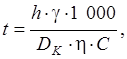
| (5.4) |
где h – средняя толщина покрытия, мм; g – плотность осаждаемого металла, кг/м3;  – плотность тока, кА/м2; S K – площадь катода, м2; С – электрохимический эквивалент, г/А×ч; h – выход металла по току, %.
– плотность тока, кА/м2; S K – площадь катода, м2; С – электрохимический эквивалент, г/А×ч; h – выход металла по току, %.
Наибольшее распространение в ремонтном производстве получили процессы электролитического наращивания хрома, железа, никеля, меди и цинка. В ряде случаев применяется технология нанесения электролитическим путем некоторых износостойких сплавов.
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 1204; Нарушение авторских прав?; Мы поможем в написании вашей работы!