
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уровень b
|
|
|
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: СО, Mn(OH)2, H2SO4, KHS, Na2CO3, FeOH(NO3)2.
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Ответ:
а) С+2О-2 – оксид углерода (II),
Mn+2 (O-2H+1)2 – гидроксид марганца (II),
Н+12S+4O-23 – сернистая кислота,
К+1Н+1S-2 – гидросульфид калия,
Na2+1С+4О-23 – карбонат натрия,
Fe+3O-2H+1(N+5O-23)2 – нитрат гидроксожелеза (III).
б) оксид свинца (IV) – PbO2,
сульфат лития – Li2SO4,
хлорид гидроксоцинка – ZnOHCl;
дигидроортофосфат алюминия – Al(H2PO4)3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ В
1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
Дано:
 68,90 % мас.
В = 3 68,90 % мас.
В = 3
| Решение Чтобы назвать элемент, необходимо вычислить молярную массу атома элемента (М э). М э = М эк(Э)·В, |
| М эк(Э) –? Э –? |
где Мэк(Э)·– молярная масса эквивалента элемента;
В – валентность элемента.
По закону эквивалентов n эк(Э) = n эк(О), т.е.
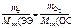 ,
,
откуда Мэк (Э) = 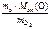 .
.
М эк(О) = 8 г/моль.
m окс = m э +  ;
;  = 68,9 г.
= 68,9 г.
m э = 100 – 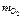 = 100 – 68,9 = 31,1 г.
= 100 – 68,9 = 31,1 г.
М эк(Э) = 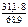 = 3,61 г/моль
= 3,61 г/моль
М эк(Э) = 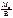 ,
,
М э = М эк(Э) ∙ В = 3,61∙3 = 10,83 г/моль, что соответствует молекулярной массе атома бора.
Ответ: М эк(Э) = 3,61 г/моль; элемент – В.
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла.
Дано:
m окс. = 7,2 г
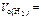 2,24 л 2,24 л
| Решение
По закону эквивалентов
nэк(окс) = nэк(H2),
 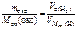 , ,
|
| М эк(окс.) –? М эк(Ме) –? |
где  = 11,2 л/моль.
= 11,2 л/моль.
М эк(окс) =  =
= 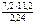 = 36 г/моль;
= 36 г/моль;
М эк(окс) = М эк(Ме) + М эк(О);
М эк(Ме) = М эк(окс) – М эк(О) = 36 – 8 = 28 г/моль.
Ответ: М эк(окс) = 36 г/моль;
М эк(Ме) = 28 г/моль.
3. Хлорид некоторого металла (MeClх) массой 0,493 г обработали избытком раствора AgNO3. При этом образовалось 0,86 г AgCl. Вычислить молярную массу эквивалента металла.
Дано:
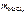 = 0,493 г = 0,493 г
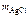 = 0,86 г = 0,86 г
| Решение
По закону эквивалентов nэк(МеCl х) = = nэк(AgCl) т.е.
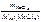 = =  ; ;
|
| M эк(Me) –? |
 =
= 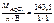 143,5 г/моль.
143,5 г/моль.
где 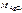 – молярная масса AgCl;
– молярная масса AgCl;
В – валентность серебра;
n – число атомов серебра в молекуле соли.
 =
=  ,
,
откуда 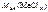 =
= 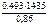 = 82,3 г/моль.
= 82,3 г/моль.
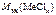 =
=  +
+ 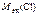 ;
;
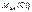
 г/моль.
г/моль.
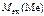 =
= 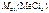 –
–  ,
,
 = 82,3 –35,5 = 46,8 г/моль.
= 82,3 –35,5 = 46,8 г/моль.
Ответ:  = 46,8 г/моль.
= 46,8 г/моль.
|
|
|
|
|
Дата добавления: 2015-03-31; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!