
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние времени на скорость реакции. Уравнение Арениуса
|
|
|
|
Билет №12
Электролиз водного раствора NaCl.
Электролиз. Его практическое применение.
Электролиз – окислительно-восстановительная реакция, которая протекает на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
На катод - Na++e=Na0
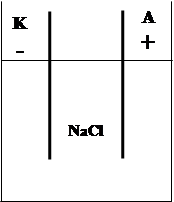 На анод + 2Cl--2e=Cl2
На анод + 2Cl--2e=Cl2
NaCl расплав.
Na+Cl-
Щелочные, щелочноземельные металлы, редкоземельные, Al, малибден, Ti, Mg, W получают методом электролиза из расплава солей.
Na+, Cl-, H2O
На катод - Na++e=Na0 j0= -2,87B
H+2O+2e=H2+2OH- j0= -0,83B (по таблице окислительно-восстановительного потенцирования).
На катоде в первую очередь разряжается тот ион, для разряда которого надо приложить наименьшее электроотрицательное значение потенцирования.
(+)A 2Cl--2e=Cl2 j0= 1,36B
2H2O2--4e=O2+4H+ j0= 1,229B j0фактическое (H2O)= 1,6-1,8В
Согласно правилу разряда ионов на аноде разряжается тот ион, для разряда которого надо приложить наименьшее электроположительное значение потенцирования.
Однако существует явление перенапряжения.
m = jфактическое-jравновесное
Сдвиг потенциала от равновесного значения.
За счет перенапряжения на Аноде выделяется Cl.
Империческое правило Ван Гоффа говорит: при повышении температуры на 10 град. Скорость химической реакции возрастает в 2….4 раза.
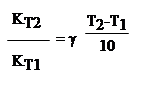
где g=2....4 - температурный коэффициент
Арениус показал почему реакции протекают не со скоростью взрыва, а подчиняются правилу Ван Гоффа.
В химическое взаимодействие вступают только те молекулы, энергия которых больше или равна энергии активации.
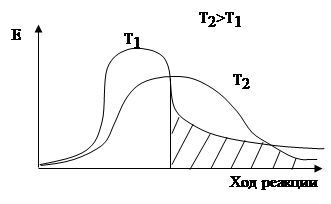 | |||
| |||
K=A*e–Ea/RT
K – константа скорости
A – предэкспонентационный множитель
ln KT2/ KT1=(Ea/R)(1/T1-1/T2)
Основные положения теории Арениуса.
Чтобы произошло химическое взаимодействие, надо:
1) столкновение молекул
2) энергия молекул должна быть больше или равна энергии активации
3) столкновение должно приходится на функциональную группу.
Недостатки теории.
1) Реальная скорость часто оказывается ниже, чем рассчитанная по теореме Арениуса
2) Она не объясняет явление катализа.
Теория активированного состояния или переходного комплекса.
H2+J2=2HJ
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 625; Нарушение авторских прав?; Мы поможем в написании вашей работы!