
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства элементов главной подгруппыIIIгруппы
|
|
|
|
Электронное строение элементов главной подгруппыIII группы
| Ат. номер | Название и символ | Электроннаяконфигурация | Атомныйрадиус, нм. | ПИ, эВ | ЭО по Полингу | Степениокисления |
| Бор В | [Не]2s22р1 | 0,083 | 8,3 | 2,0 | +3 | |
| Алюминий Аl | [Nе]3s2Зр1 | 0,143 | 6,0 | 1,5 | +3 | |
| Галлий Gа | [Аr]3d104s24р1 | 0,122 | 6,0 | 1,6 | + 1, +3 | |
| Индий In | [Кr]4d105s25р1 | 0,163 | 5,8 | 1,7 | + 1, +3 | |
| Таллий Тl | [Хе]4f145d106s26р1 | 0,170 | 6,1 | 1,8 | + 1, +3 |
С увеличением атомной массы усиливается металлический характер элементов. Бор — неметалл, остальные элементы (подгруппа алюминия) — металлы. Бор значительно отличается по свойствам от остальных элементов и больше похож на углерод и кремний. Остальные элементы — легкоплавкие металлы, In и Тl — чрезвычайно мягкие.
| Элемент | Энергия связи, эВ | ρ, г/см3 | tпл, °C | tкип, °C |
| В | 5,83 | 2,34 | ||
| Аl | 3,38 | 2,70 | ||
| Gа | 2,87 | 5,91 | 29,8 | |
| In | 2,52 | 7,30 | ||
| Тl | 1,89 | 11,85 |
Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен).
В ряду В—Аl—Gа—In—Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН)3. Н3ВО3 — кислота, Аl(ОН)3 и Gа(ОН)3 — амфотерные основания, In(ОН)3 и Тl(ОН)3 — типичные основания. ТlOН — сильное основание.
Далее рассмотрим свойства только двух элементов: подробно — алюминия, как типичного представителя р-металлов, чрезвычайно широко применяемого на практике, и схематично — бора, как представителя «полуметаллов» и проявляющего аномальные свойства по сравнению со всеми другими элементами подгруппы.
Алюминий - самый распространенный металл на Земле (3-е место среди всех элементов; 8% состава земной коры). В виде свободного металла в природе не встречается; входит в состав глиноземов (Аl2О3), бокситов (Аl2О3 • xН2О). Кроме того, алюминий обнаруживается в виде силикатов в таких породах, как глины, слюды и полевые шпаты.
Содержание бора в земной коре составляет всего 0,001%. Его важнейшим природным минералом является бура Na2B4O7.10Н2О.
Алюминий имеет единственный стабильный изотоп 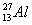 , бор — два:
, бор — два: 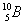 19,9% и
19,9% и 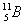 80,1%.
80,1%.
Физические свойства. Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Алюминий имеет невысокую плотность — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
Бор существует в нескольких аллотропных модификациях. Аморфный бор представляет собой темно-коричневый порошок. Кристаллический бор — серо-черный, с металлическим блеском. По твердости кристаллический бор занимает второе место (после алмаза) среди всех веществ. При комнатной температуре бор плохо проводит электрический ток; так же, как кремний, он обладает полупроводниковыми свойствами.
Химические свойства. Поверхность алюминия обычно покрыта прочной пленкой оксида Аl2О3, которая предохраняет его от взаимодействия с окружающей средой. Если эту пленку удаляют, то металл может энергично реагировать с водой:
2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2↑.
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
2Аl + 3/2O2 = Аl2О3 + 1676 кДж.
Это обстоятельство используется для получения ряда металлов из их оксидов методом алюмотермии. Так назвали восстановление порошкообразным алюминием тех металлов, у которых теплоты образования оксидов меньше теплоты образования Аl2О3, например:
Сr2О3 + 2Аl = 2Сr + Аl2О3 + 539 кДж.
Бор, в отличие от алюминия, химически инертен (особенно кристаллический). Так, с кислородом он реагирует только при очень высоких температурах (> 700°С) с образованием борного ангидрида В2О3:
2В + ЗО2 = 2В2О3,
с водой бор не реагирует ни при каких обстоятельствах. При еще более высокой температуре (> 1200°С) он взаимодействует с азотом, давая нитрид бора (служит для изготовления огнеупорных материалов):
2B + N2 = 2BN.
Лишь со фтором бор реагирует при комнатной температуре, реакции же с хлором и бромом протекают только при сильном нагревании (400 и 600 °С соответственно); во всех этих случаях он образует тригалогениды ВНal3 — дымящие на воздухе летучие жидкости, легко гидролизующиеся водой:
2В + 3Наl2 = 2ВНаl3.
В результате гидролиза образуется ортоборная (борная) кислота H3BO3:
ВНаl3 + 3Н2О = Н3ВО3 + ЗННаl.
В отличие от бора, алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С):
2Аl + 3S = Аl2S3 (сульфид алюминия),
2Аl + N2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl4С3 (карбид алюминия).
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
2Аl + 6НСl = 2АlСl3 + ЗН2↑.
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
В разбавленной серной кислоте алюминий растворяется с выделением водорода:
2Аl + 3Н2SО4 = Аl2(SО4)3 + 3Н2.
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
Аl + 4HNО3 = Аl(NО3)3 + NO + 2Н2О.
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
2Аl + 2NаОН + 6Н2О = 2Na[Аl(ОН)4] + 3Н2↑.
Кислоты, не являющиеся окислителями, с бором не реагируют и только концентрированная HNO3 окисляет его до борной кислоты:
В + HNO3(конц) + Н2О = Н3ВO3 + NO↑
- Бор. Строение атома, валентность. Важнейшие соединения. Применение.
- алюминий и его соединения. Применение.
Алюминий — основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов — галлия, индия и таллия — напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2nр1 и могут проявлять степень окисления +3.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!