
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего
|
|
|
|
Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один сверхоктетный с предпоследнего энергетического уровня), проявляет степень окисления +3.
Fe+3®Fe+2 Fe-3e-®Fe-2e-
Электронные структуры 3d- и 4s-орбиталей атома железа и ионов Fe+2 и Fe+3 можно изобразить так:
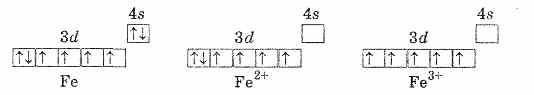 Другие степени окисления для железа не характерны.
Другие степени окисления для железа не характерны.
• По химическим свойствам железо является весьма активным металлом. В сухом воздухе при температуре до 200°С на поверхности компактного железа образуется тончайшая оксидная пленка, защищающая металл от дальнейшего окисления. При воздействии влаги и кислорода воздуха подвергается сильной коррозии и покрывается рыхлой пленкой ржавчины, представляющей собой гидроксиды железа, которые не защищают его от дальнейшего окисления. Железо постепенно окисляется по всей своей массе:
4Fe+3O2+6Н2O=4Fe(OH)3
Разработан ряд методов защиты этого ценнейшего металла от коррозии.
При слабом нагревании железо взаимодействует с хлором и другими галогенами, проявляя степень окисления +3:
2Fe+3Cl2 = 2FeCl3
Железо при нагревании реагирует с серой:
Fe+S=FeS
При высокой температуре — с углем, кремнием, фосфором:
3Fe+C=Fe3C
Карбид железа называется цементит. Это твердое вещество серого цвета, очень хрупкое и тугоплавкое.
Раскаленное железо в чистом кислороде энергично сгорает с образованием железной окалины:
4Fe+3O2=2Fe2O3
В ряду напряжений железо располагается левее водорода. Оно легко подвергается действию разбавленных кислот, превращаясь в соль железа (II):
Fe+2HCl=FeCl2+H2
С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции.
Растворяется железо в разбавленной азотной кислоте, образуя соль железа (III), воду и продукт восстановления азотной кислоты—NH4NO3:
8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O
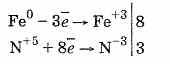
При высокой температуре (700-900°С) железо реагирует с парами воды:
3Fe+4Н2O=Fe3O4+4Н2
С металлами и неметаллами железо образует сплавы, имеющие исключительное большое значение в народном хозяйстве.
Важнейшими сплавами железа являются его сплавы с углеродом — различные чугуны и стали. Основное отличие чугуна от стали — в содержании углерода: в чугуне содержится более 2% углерода, в стали менее 1,5-2%.
Железо входит также в состав животных и растительных организмов. Так, в организме человека железо входит в состав гемоглобина, который является компонентом крови.
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
§ Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
§ Железо может входить в состав сплавов на основе других металлов — например, никелевых.
§ Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
§ Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
§ Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
§ Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
§ Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
§ Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
§ Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 979; Нарушение авторских прав?; Мы поможем в написании вашей работы!