
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые свойства s-металлов
|
|
|
|
| Элемент | Металлический радиус, нм | Ионныйрадиус,нм | ПИ, эВ | ЭО поПолингу | ρ, г/см3 | tпл,°С | tкип,°С |
| Группа I | |||||||
| Li | 0,152 | 0,078 | 5,32 | 1,0 | 0,53 | ||
| Na | 0,190 | 0,098 | 5,14 | 0,9 | 0,97 | ||
| К | 0,227 | 0,133 | 4,34 | 0,8 | 0,86 | ||
| Rb | 0,248 | 0,149 | 4,18 | 0,8 | 1,53 | ||
| Cs | 0,265 | 0,165 | 3,89 | 0,8 | 1,87 | ||
| Группа II | |||||||
| Ве | 0,113 | 0,034 | 9,32 | 1,6 | 1,85 | ||
| Мg | 0,160 | 0,078 | 7,65 | 1,3 | 1,74 | ||
| Са | 0,197 | 0,106 | 6,11 | 1,0 | 1,55 | ||
| Sr | 0,215 | 0,127 | 5,70 | 1,0 | 2,54 | ||
| Ва | 0,217 | 0,148 | 5,21 | 0,9 | 3,59 |
При обычных условиях s-металлы находятся в кристаллическом состоянии. Все металлы I группы имеют объемно-центрированную кубическуюупаковку. Бериллий и магний имеют гексагональную плотную упаковку (ГПУ), кальций и стронций — гране-центрированную кубическую упаковку (ГКУ), барий — ОЦКУ.
Металлы I группы — мягкие и имеют небольшую плотность по сравнению с другими. Литий, натрий и калий легче воды и плавают на ее поверхности, реагируя с ней. Металлы II группы тверже и плотнее щелочных. Низкие значения температур плавления и кипения s-металлов объясняются сравнительно слабыми металлическими связями в кристаллических решетках этих металлов. Так, энергия связи (в эВ) лития составляет 1,65; натрия — 1,11; калия — 0,92; рубидия — 0,84; цезия — 0,79; соответствующие значения у бериллия — 3,36; магния — 1,53; кальция — 1,85; стронция— 1,70; бария— 1,87.
Металлические связи образуются делокализованными валентными электронами, удерживающими вместе положительные ионы атомов металла. Чем больше металлический радиус в каждой из групп, тем более «тонким слоем» распределены делокализованные электроны по положительным ионам и тем слабее связь. Этим и объясняются низкие температуры плавления и кипения для металлов I и II групп. Температуры плавления и кипения во II группе в отличие от щелочных металлов изменяются несистематически, что объясняется неодинаковой кристаллической структурой у металлов этой группы.
На свежем разрезе s-металлы имеют блестящую поверхность, однако, вступая в контакт с кислородом воздуха, они окисляются и быстро тускнеют,поэтому в случае необходимости их хранят под слоем керосина (за исключением бериллия и магния, которые образуют на поверхности защитный слой оксида).
Все s-металлы горят в атмосфере воздуха, образуя оксиды одного или нескольких типов — нормальные оксиды состава Ме2О (I группа) и МеО(II группа), пероксиды состава Мe2O2 (I группа) и МеО2 (II группа), супероксиды состава МеО2 (I группа) и МеО4 (II группа).
Например, только литий сгорает на воздухе с образованием оксида
4Li + О2 = 2Li2О,
а натрий образует смесь пероксида и супероксида:
3Na + 2О2 = Nа2О2 + NаО2.
Оксиды натрия и калия могут быть получены только при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
К2О2 + 2К = 2К2О.
Все s-металлы, за исключением бериллия, соединяются с водородом при нагревании, образуя гидриды; при взаимодействии с галогенами, серой,азотом, фосфором, углеродом и кремнием образуются соответственно галогениды, сульфиды, нитриды и фосфиды, карбиды и силициды.
При взаимодействии щелочных металлов с водой образуются щелочи и водород. Активность металлов возрастает сверху вниз по группе. Так,литий реагирует с водой относительно медленно, тогда как калий реагирует со взрывом и горит фиолетовым пламенем на поверхности воды.
2Li + 2Н2О = 2LiOН + Н2↑.
Реакционная способность щелочноземельных металлов падает при перемещении снизу вверх II группы. Барий, стронций и кальций энергично реагируют уже с холодной водой:
Са + 2Н2О = Са(ОН)2 + Н2↑.
Магний очень медленно реагирует с холодной водой, но бурно с водяным паром. Бериллий практически не реагирует с холодной водой и медленно реагирует не только с горячей водой, но даже с паром.
С кислотами все щелочные металлы реагируют со взрывом, поэтому такие реакции специально не проводят. Щелочноземельные металлы также бурно реагируют с кислотами; исключением является бериллий.
Металлы I группы, а также кальций, стронций и барий при взаимодействии с жидким аммиаком или при нагревании в парах аммиака,образуют амиды и водород:
2Nа + 2NН3 = 2NаNН2 + Н2↑.
Образующиеся амиды — кристаллы, легко гидролизующиеся с образованием щелочи и аммиака:
КNН2 + Н2О = КОН + NН3↑.
Металлы I и II групп (за исключением бериллия) могут взаимодействовать со спиртами, образуя алкоголяты:
НОСН2-СН2ОН + 2Nа → NaОСН2-СН2ОNа + Н2↑,
а также с органическими кислотами, образуя соли, подобные ацетату натрия СН3СООNа. Натриевые соли высших жирных кислот широко используются для получения мыла.
Щелочные и щелочноземельные металлы способны вступать в реакции и со многими другими органическими веществами, образуя большой набор так называемых металлоорганических соединений.
Получение. Большинство s-металлов имеют высокие электродные потенциалы и являются сильнейшими среди известных восстановителей.Поэтому электролиз водных растворов солей этих металлов не приводит к получению самих металлов, а лишь к образованию щелочей. Свободные металлы получают электролизом расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы.
Для получения магния в промышленных масштабах часто используют морскую воду. На первой стадии катионы Мg2+, содержащиеся в морской воде,осаждают в виде гидроксида магния:
Мg2+ + Са(ОН)2 = Мg(ОН)2↓ + Са2+.
Далее гидроксид превращают в хлорид магния с помощью соляной кислоты:
Мg(ОН)2 + 2НСl = МgСl2 + 2Н2О,
выпаривают полученный раствор, прокаливают и уже затем подвергают электролизу расплав МgСl2.
- Хром. Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
Строение. Cr, химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996; Хром является металлом, для него характерна металлическая кристаллическая решетка, металлическая связь.
Физические свойства. Металл серебристо-белого цвета с металлическим блеском. Относится к тяжелым металлам с достаточно высокой температурой кипения и плавления.
Химические свойства. При высоких температурах хром горит в кислороде с образованием Сr2O3, в раскаленном состоянии он реагирует с парами воды:

при нагревании с галогенами хром образует галогениды состава СrНаl3.
В азотной и концентрированной серной кислотах хром не растворяется, так как его оксидная пленка упрочняется, т. е. хром переходит в пассивное состояние.
Хром пассивируется холодными концентрированными Н2SO4 и HNO3. Однако при сильном нагревании эти кислоты растворяют хром:

Пассивацию хрома можно устранить очисткой поверхности металла.
Хром растворяется при обычной температуре в разбавленных кислотах (НСl, HBr, HI, H2SO4) с выделением водорода. В этих случаях в отсутствие воздуха образуются соли Сr2+, а на воздухе — соли Сr3+.
При высокой температуре хром горит в кислороде, образуя оксид Сr2О3.
Металлический хром при нагревании реагирует также с галогенами, галогеноводородами, серой, азотом, фосфором, углем, кремнием и бором. Например:
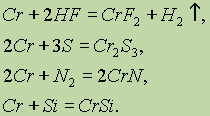
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 778; Нарушение авторских прав?; Мы поможем в написании вашей работы!