
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксид углерода (IV), Угольная кислота и ее соли
|
|
|
|
Оксид углерода (IV) (диоксид углерода, углекислый газ) - газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха. Он растворим в воде (88 объемов СО2 в 100 объемах Н2О при 20°С). При обычных давлениях твердый диоксид углерода переходит в газообразное состояние (сублимируется), минуя жидкое состояние. При обычной температуре под давлением 60 атм переходит в жидкость.
При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации в воздухе до 3% у человека наблюдается учащенное дыхание, более 10% - потеря сознания и даже смерть.
Оксид углерода (IV) является ангидридом угольной кислоты Н2СО3 и обладает всеми свойствами кислотных оксидов.
При растворении СО2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:
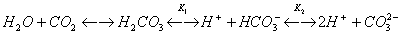
Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой (K1 = 4∙10-7, К2 = 5∙10-11 при 25 °С). Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли - карбонаты и кислые - гидрокарбонаты. Качественная реакция на эти соли - действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
СО32-+ 2Н+  Н2СО3
Н2СО3  Н2О + СО2↑,
Н2О + СО2↑,
НСО3- + Н+  Н2СО3
Н2СО3  Н2О + СО2↑.
Н2О + СО2↑.
При пропускании выделяющегося СО2 в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
| СаСО3 | + | H2O | + | CO2 | = | Са(НСО3)2 |
| взвесь в воде | избыток |
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду:
2NаНСО3 = Nа2СО3 + Н2О + СО2↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
МgСО3 = МgО + СО2↑.
Из солей угольной кислоты наибольшее практическое значение имеет сода; известны различные кристаллогидраты соды Nа2СО3∙10Н2О,Nа2СО3.7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называюткристаллической содой. При прокаливании получают безводную, или кальцинированную соду Nа2СО3. Широко используется также питьеваясода NаНСО3. Из других солей важное значение имеют К2СО3 и СаСО3.
Основные количества соды получают получают по аммиачному способу, часто его называют также методом Сольвэ.
Суть метода заключается в насыщении концентрированного раствора поваренной соли (точнее, насыщенного раствора NаСl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NН3 + СО2 + Н2О = NН4НСО3,
NН4НСО3 + NаСl = NаНСО3↓ + NН4Сl.
Питьевая сода NaНСО3 - нерастворима в холодном насыщенном растворе и ее отделяют фильтрованием. При прокаливании NаНСО3получают кальцинированную соду; выделяющийся при этом СО2 вновь используют в производстве:
2NаНСО3 = Na2СО3 + СО3 + Н2О.
Нагревая раствор, содержащий хлорид аммония с известью, выделяют обратно аммиак:
2NН4Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2О.
Таким образом, при аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО3 нельзя получить по методу Сольвэ, так как он основан на малой растворимости кислой соли NаНСO3 в насыщенном растворе, тогда как КНСО3 (в отличие от NаНСО3) хорошо растворим в таких растворах. Реакция
КСl + NН4НСО3  КНСО3 + NН4Сl
КНСО3 + NН4Сl
будет полностью обратимой (ни один из продуктов не удается выделить из сферы реакции в индивидуальном виде). Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
КОН + СО2 = КНСО3,
КНСО3 + КОН = К2СО3 + Н2О.
Производство соды является одним из крупнейших среди производств неорганических веществ; в настоящее время ее мировое производство составляет десятки млн. тонн.
ЦИАНИДЫ, неорг. соединения, содержащие группу CN. Различают простые Ц.- соли синильной кислотыHCN и нек-рые др. (см. ниже) и комплексные.
- Кремний, строение атома. Важнейшие соединение, их свойства, применение.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1214; Нарушение авторских прав?; Мы поможем в написании вашей работы!