
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов подгруппы кислорода
|
|
|
|
| Свойства | O | S | Se | Те | Ро |
| 1. Порядковый номер | |||||
| 2. Валентные электроны | 2s22р4 | Зs23р4 | 4s24р4 | 5s25p4 | 6s26p4 |
| 3. Энергия ионизации атома, эВ | 13,62 | 10,36 | 9,75 | 9,01 | 8,43 |
| 4. Относительная электроотрицательность | 3,50 | 2,6 | 2,48 | 2,01 | 1,76 |
| 5. Степень окисления в соединениях | -1, -2, +2 | -2, +2, +4, +6 | -2, +4, +6 | -2, +4, +6 | -2, +2 |
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
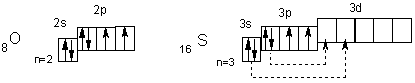
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6.
Водородные соединения элементов подгруппы кислорода отвечают формуле Н2R (R - символ элемента): Н2О, Н2S, Н2Sе, Н2Те. Они называютсяхальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлическиесвойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
- Вода. Физические и химические свойства. Вода как растворитель. Биологическая роль воды.
Вода́ (оксид водорода) — химическое вещество в виде прозрачной жидкости, не имеющей цвета (в малом объёме),запаха и вкуса (при нормальных условиях). Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра,реки, лёд).
Химические свойства:
Вода химически довольно активное вещество.
Вода реагирует:
1. Со щелочными (натрий, калий) и щелочноземельными металлами (кальций, барий и др.)
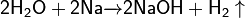
2. Вода также реагирует с некоторыми другими активными металлами (железо, магний) при нагревании

3. С галогенами (фтором, хлором) и межгалоидными соединениями
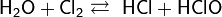
4. С оксидами, щелочных и щелочноземельных металлов с образование щелочей. Например в реакции гашения извести:
СаО+Н2О = Са(ОН)2
5. С кислотными оксидами с образованием кислот (исключение SiO2):
P2O5+3H2O=2H3PO4
6. Вступает в обменную реакцию с солями слабых кислот и слабых оснований – гидролиз солей.
Na2CO3 + Н2О = NaHCO3 + NaOH
CO32−+ H2O = HCO3−+ OH−
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 665; Нарушение авторских прав?; Мы поможем в написании вашей работы!