
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение
|
|
|
|
Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом.
При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор.

| Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора (колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор (устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия. |
Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху.
Электролиз протекает по следующей схеме:
NaCl  Na+ + Сl- Na+ + Сl-
| ||
Н2О  Н+ + ОН- Н+ + ОН-
| ||
| ↓ ↓ ↓ | ||
| (-) Катод | (+) Анод | |
| 2Н+ + 2е = Н2↑ | 2Н+ + 2е = Н2↑ 2Cl - 2e = Cl2 | |
| 2NaCl + 2Н2О = Н2↑ + 2NaОН + Сl2↑. |
В этом процессе требуется предотвратить соприкосновение выделяющегося на аноде хлора с накапливающимся у катода раствором гидроксида натрия (получающийся в этом случае NaOH имеет давнее техническое название «каустическая сода»), так как эти вещества могут реагировать между собой. Именно по этой причине анодное пространство обязательно отделяется от катодного полупроницаемой диафрагмой из асбеста
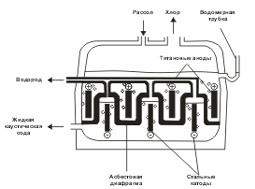
| Диафрагма препятствует проникновению газа (молекул Сl2) в катодное пространство, но не препятствует прохождению электрического тока и ионов. Для получения брома и йода также можно использовать электролиз их солей, однако на практике обычно окисляют их соли, применяя в качестве окислителя хлор. Такой метод оказывается выгодным экономически, так как Сl2 сравнительно дешевый реагент, а иодиды, и особенно бромиды, просто «черпают» из морской воды (!). |
Лабораторные способы получения галогенов. Хлор получают действием различных окислителей на соляную кислоту, например:
МnО2 + 4НСl = МnСl2 + Сl2↑ + 2Н2О.
Еще более эффективно окисление проводится такими окислителями, как РbО2, КМnО4, КСlO3, К2Сr2О7.
Аналогично получают в лабораториях бром и иод, окисляя НВr, НI или их соли. В качестве примера кратко опишем здесь практически используемую лабораторную методику получения брома по реакции:
6КВr + К2Сr2О7 +7Н2SО4 = ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О.
В колбу 1  соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью. соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью.
|
Применение:
Хлор используется для отбеливания бумаги и тканей, обеззараживания питьевой воды, производства различных. ядохимикатов, соляной кислоты, хлорорганических веществ и растворителей, а также в лабораторной практике.
Йод применяют при глубокой очистке металлов, синтезе лекарств.
Бром применяют для получения различных броморганических соединений, используемых в лакокрасочной и фармацевтической промышленности. Значительные количества брома расходуются для получения бромида серебра, используемого в качестве светочувствительного вещества при изготовлении кинофотоматериалов.
Фтор входит в состав полимеров, лекарств, моющих средств, ядохимикатов, красителей, компонентов искусственной крови.
Фториды используются в медицине, растениеводстве и животноводстве. С ними связывают перспективу лечения рака и регулирования наследственности, создание мощных психотропных средств, транквилизаторов, антибиотиков.
- Водородные соединения галогенов. Свойства, применение.
Галогены реагируют с водородом, образуя HX, причем со фтором и хлором реакция протекает со взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2 и I2. Для протекания реакции с водородом достаточно активировать небольшую долю реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют с неактивированными, образуя HX и новые активированные частицы, которые продолжают процесс, а реакция двух активированных частиц по главной реакции заканчивается образованием продукта. Например, образование HCl из H2 и Cl2:

Более удобные методы получения галоиодоводородов, чем прямой синтез, дают, например, следующие реакции:
В газообразном состоянии HX являются ковалентными соединениями, однако в водном растворе они (за исключением HF) становятся сильными кислотами. Объясняется это тем, что молекулы воды эффективно оттягивают водород от галогена. Все кислоты хорошо растворимы в воде благодаря гидратации: HX + H2O -> H3O+ + X
HF более склонен к комплексообразованию, чем другие галогеноводороды. Заряды на H и F так велики, а эти атомы так малы, что происходит образование HX-ассоциатов типа полимеров состава (HF)x, где x і 3. В таком растворе диссоциация под действием молекулы воды идет не более чем на несколько процентов от общего количества ионов водорода. В отличие от других галогеноводородов фтороводород активно реагирует с SiO2 и силикатами, выделяя газообразный SiF4. Поэтому водный раствор HF (плавиковая кислота ) используют в травлении стекла и хранят не в стеклянной, а в парафиновой или полиэтиленовой посуде. Чистый HF кипит чуть ниже комнатной температуры (19,52° С), поэтому его хранят в виде жидкости в стальных цилиндрах. Водный раствор HCl называют соляной кислотой. Насыщенный раствор, содержащий 36% (масс.) HCl, широко используют в химической промышленности и лабораториях
- Хлорная вода. Получение, свойства, применение.
Хлорная вода — водный раствор хлора. Содержит молекулы хлора (Cl2), хлорноватистую кислоту (HClO) и хлороводород (HCl). Хлорноватистая кислота и хлороводород образуются по реакции диспропорцинирования:

Получают в хлораторе, путем насыщения воды газообразным хлором
Свойства: Сильный окислитель, прежде всего благодаря образованию атомарного кислорода в момент выделения.
Применение: Используется для обеззараживания воды в бассейнах способом хлорирования, очень слабый раствор хлора в питьевой воде обеспечивает ее обеззараживания без нанесения большого ущерба здоровью.
- Хлорная известь. Получение, свойства, применение.
Хло́рная и́звесть Ca(Cl)OCl — смесь гипохлорита, хлорида и гидроксида кальция. Относится к так называемым смешанным солям.
Получают взаимодействием хлора с гашеной известью (гидроксидом кальция):
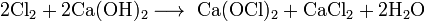 .
.
Реально продукт, получаемый хлорированием гидроксида кальция, является смесью соединений, образованных молекулами Ca(OCl)2, CaCl2, Ca(OH)2 и кристаллизационной воды. Формально его состав выражают формулой Ca(Cl)OCl.
Свойства: На воздухе хлорная известь медленно разлагается по схеме:
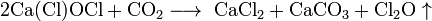 .
.
 , термическое разложение
, термическое разложение
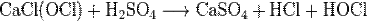

Применение: Широко используется для отбеливания и дезинфекции.
- Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
Кислородсодержащие соединения галогенов. Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Наиболее важными из таких соединений являются кислородсодержащие кислоты галогенов типа НСlOn (n = 1— 4) и соответствующие им соли и ангидриды.
Рассмотрим структурные формулы этих кислот:

Хлорноватистая

Хлористая
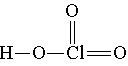
Хлорноватая

Хлорная
Для диссоциации по кислотному типу необходим разрыв связи О—Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO — HClO2 — НClO3 — НClO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О—С1 оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О—Н, которая за счет этого ослабляется.
Характерная закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома.
Из солей кислородсодержащих кислот хлора наибольшее значение имеют бертолетова соль (хлорат калия) КсlO3 и хлорная (“белильная”) известь. В лабораторной практике КClO3 широко используется для получения О2 (в присутствии MnO2 в качестве катализатора).
Хлорную известь получают действием хлора на гидроксид кальция (“гашеную известь”):

Получаемую смесь называют хлорной известью. Если формально просуммировать состав хлорной извести, то его можно выразить как CaOCl2. Таким образом, хлорная известь представляет собой смешанную соль — хлорид-гипохлорит кальция.
Галогениды. Хлорид натрия (другие названия: каменная соль, поваренная соль, галит) NaCl является приправой к пище, служит сырьем для получения гидроксида натрия, хлора, соляной кислоты, соды и др.; используется для консервирования пищевых продуктов. Хлорид калия КСl — ценное калийное удобрение. Хлорид цинка ZnCl2 используется для пропитки древесины в целях предохранения от гниения; применяется также при паянии для смачивания поверхности металла (устраняет пленку оксида и припой хорошо пристает к металлу); известны кристаллогидраты ZnCl2 Ч nН2О. Хлорид бария BaCl2 — ядовитое вещество, применяемое для борьбы с вредителями сельского хозяйства (свекловичным долгоносиком, луговым мотыльком и др.). Хлорид кальция CaCl2 (безводный) — широко применяется для осушки газов (при этом образуется кристаллогидрат соли СаСl2 Ч 6Н2O) и в медицине. Хлорид алюминия АlCl3 (безводный) часто используется как катализатор при органических синтезах. Хлорид ртути (II), или сулема, HgCl2 — сильный яд; очень разбавленные растворы соли применяются как сильнодействующее дезинфицирующее средство; используется также для протравливания семян, дубления кожи, в органическом синтезе. Хлорид серебра AgCl — малорастворимая соль, используется в фотографии.
- Общая характеристика подгруппы кислорода.
В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д.И.Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды».
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 4243; Нарушение авторских прав?; Мы поможем в написании вашей работы!