
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов подгруппы углерода
|
|
|
|
Мышьяк - сильный яд для животных и микроорганизмов, а соединение его с кислородом приводит к образованию мышьяковистого водорода. Мышьяковистый водород - газ, обладающий неприятным чесночным запахом и сильнейшей токсичностью.
Растворитель Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
Биологическая роль. Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
- Сероводород, получение, свойства. Сероводородная кислота. 1-я и 2-я константы диссоциации. Роль в окислительно-восстановительных процессах. Соли сероводородной кислоты.
Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц.
При нагревании серы с водородом происходит обратимая реакция с очень малым выходом сероводорода. Обычно в лаборатории его получают действием разбавленных кислот на сульфиды:
FеS + 2НСl = FеСl2 + Н2S↑.
Другой способ получения сероводорода заключается в добавлении холодной воды к сульфиду алюминия:
Аl2S3(тв) + 6Н2O(ж.) = 2Аl(ОН)3↓ + ЗН2S↑.
Сероводород, полученный таким способом, оказывается чище.
Сероводород – ковалентное соединение. Его молекулы имеют изогнутую структуру, подобную структуре воды. Однако, в отличие от воды, молекулы сероводорода не образуют между собой водородных связей. Дело в том, что атом серы менее электроотрицателен, чем атом кислорода, и имеет больший размер. Поэтому сера имеет гораздо меньшую плотность заряда, чем кислород. Из-за отсутствия водородных связей сероводород имеет более низкую температуру кипения, чем вода. Отсутствие водородных связей в сероводороде объясняет также его плохую растворимость в воде. Одинобъем воды растворяет 3 объема сероводорода.
Сероводород – типичный восстановитель. В кислороде он сгорает, легко окисляется галогенами:
Н2S + Вr2 = S↓ + 2НВr.
Раствор сероводорода в воде – это очень слабая кислота, которая диссоциирует ступенчато(K1, K2 константы диссоциации):
H2S  H+ + HS- (K1 = 6∙10-8),
H+ + HS- (K1 = 6∙10-8),
HS-  H+ + S2- (K2 = 1∙10-14).
H+ + S2- (K2 = 1∙10-14).
Сероводородная кислота так же, как и сероводород, - типичный восстановитель и окисляется не только сильными окислителями, например хлором:
Н2S + 4Сl2 + 4Н2О = Н2SО4 + 8НСl,
но и более слабыми, например сернистой кислотой Н2SО3 и SО2:
2Н2S + Н2SО3 = 3S↓ + ЗН2О
или ионами трехвалентного железа:
2FеСl3 + Н2S = 2FеСl2 + S↓ + 2НСl.
Сероводородная кислота может реагировать с основаниями, основными оксидами или солями, образуя два ряда солей: средние - сульфиды, кислые - гидросульфиды. Большинство из них (за исключением сульфидов аммония, а также щелочных и щелочноземельных металлов) плохо растворимо в воде. Например, при пропускании сероводорода через раствор, содержащий ионы свинца Рb2+,образуется черный осадок сульфида свинца:
Рb2+ + Н2S = PbS↓ + 2Н+.
Эта реакция используется для обнаружения сероводорода сульфид-ионов.
Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу.
Помимо сульфидов известны и полисульфиды; наиболее хорошо изучены дисульфиды щелочных металлов и аммония, легко образующиеся при нагревании серы с растворами сульфидов, например:
К2S + S = К2S2.
- Серная кислота. Роль в окислительно-восстановительных процессах. Соли серной кислоты. Применение
Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту (маслянистая жидкость)
SО3+ Н2О = Н2SО4
SО3 очень хорошо растворяется в 100%ной серной кислоте. Раствор SO3 в такой кислоте называется олеумом.
Серная кислота – сильная двухосновная кислота. В воде она диссоциирует ступенчато, образуя гидросульфат- и сульфат-ионы:
Н2SO4  Н+ + НSO4- (К1 = 1∙10+3),
Н+ + НSO4- (К1 = 1∙10+3),
НSO4-  Н+ + SО42- (К2=1,1∙10-2).
Н+ + SО42- (К2=1,1∙10-2).
Серная кислота принимает участие во всех реакциях, характерных для кислот.
Разбавленная серная кислота окисляет только металлы, стоящие в ряду активности до водорода, за счет ионов Н+, например:
Zn + Н2SО4(разб) = ZnSO4 + Н2↑,
в реакциях с основаниями, щелочами и оксидами образует сульфаты либо гидросульфаты.
Отметим, что из всех сульфатов наименьшей растворимостью обладает сульфат бария - именно поэтому его образование в виде белого осадка используют как качественную реакцию на сульфат-ион:
Ва2+ + SO42- = ВаSО4↓.
При прокаливании твердые сульфаты ведут себя по-разному. Так, сульфаты щелочных металлов плавятся без разложения.Сульфаты металлов средней активности образуют соответствующие оксиды:
ZnSО4 = ZnО + SО3↑.
Сульфат железа (II) разлагается по механизму внутримолекулярного окисления-восстановления:
4FeSО4 = 2Fе2О3 + 4SО2↑ + О2↑.
Наконец, сульфаты наиболее тяжелых металлов разлагаются до металла:
Ag2SO4 = 2Ag↓ + SО2↑ + О2↑,
НgSО4 = Нg + SО2↑ + О2↑.
При взаимодействии концентрированной серной кислоты с различными металлами, как правило, происходит ее восстановление до SО2, например:
Zn + 2Н2SО4(конц) = ZnSО4 + SO2↑ + 2Н2О.
Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор:
2Аg + 2Н2SО4 = Аg2SО4 + SО2↑ + 2Н2О, (3)
2Р + 5Н2SО4 = 2Н3РО4 + 5SО2↑ + 2Н2О. (4)
Концентрированная серная кислота очень бурно реагирует водой с выделением большого количества теплоты. По этой причине следует всегда,разбавляя серную кислоту, наливать ее в воду, а не наоборот. Концентрированная кислота гигроскопична, т.е. способна поглощать влагу из воздуха.Поэтому ее используют для осушения газов, не реагирующих с ней, пропуская их через серную кислоту. Сродство серной кислоты к воде настолько велико, что она может служить дегидратирующим агентом; под действием концентрированной серной кислоты углеводы, например сахароза,обугливаются:
| H2SO4 (конц) | ||
| C12H22O11(тв) | → | 12С(тв) |
| - 11H2O |
Бумага также обугливается под действием такой кислоты, что обусловлено действием кислоты на целлюлозные волокна; этанол при нагревании с серной кислотой превращается в этилен:
| H2SO4 (конц) | ||
| C2H5OH(ж) | → | CH2 = CH2 |
| - H2O |
Применение серной кислоты используют
- для производства удобрений
- при производстве синтетических моющих средств, пластмасс, фтороводорода и других реактивов
- применяется также в производстве тканей и лекарственных препаратов.
- Соединение серы в степени окисления +4. Роль в окислительно-восстановительных процессах (примеры). Применение.
Оксид серы (IV) SО2 (бесцветный газ с резким запахом) образуется при сгорании серы на воздухе, но может быть также получен при сгорании Н2S или при взаимодействии меди, а также большинства других металлов, с концентрированной серной кислотой:
Сu + 2Н2SО4(конц) = CuSО4 + SO2↑ + 2Н2О.
Диоксид серы получают также при обжиге сульфидных минералов, например, сульфида цинка или дисульфида железа (называемого также пиритомили железным колчеданом):
2ZnS + ЗО2 = 2ZnО + 2SО2↑,
4FеS2 + 11О2 = 2Fе2О3 + 8SО2↑.
Оксид серы (IV) - ангидрид сернистой кислоты Н2SО3, поэтому при растворении SО2 в воде (40 объемов в 1 объеме воды при 20 °С) частично происходит реакция с водой и образуется слабая сернистая кислота:
SO2 + Н2О  Н2SО3,
Н2SО3,
которая малоустойчива, легко распадается вновь на SО2 и Н2О. В водном растворе существуют следующие равновесия:
| K1 | K2 | |||||
| Н2О + SO2 | 
| Н2SО3 | 
| Н+ + НSО3- | 
| 2Н+ + SO32- |
Константа диссоциации Н2SО3 по первой ступени равна К1 = 1,6∙10 -2, по второй - К2 = 6,3.10-8. Кислота дает два ряда солей: средние - сульфиты, и кислые - гидросульфиты.
Химические реакции, характерные для SО2, сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:
Са(ОН)2 + SО2 = СаSО3 + Н2О.
2. Реакции с повышением степени окисления серы от +4 до +6, например:
Na2SО3 + Сl2 + Н2О = Nа2SО4 + 2НСl.
3. Реакции, протекающие с понижением степени окисления серы, например, уже отмеченное выше взаимодействие SО2 c Н2S.
4. Реакции самоокисления-самовосстановления серы возможны и при ее взаимодействии с сульфитами. Так, при кипячении раствора Nа2SО3 с мелкоизмельченной серой образуется тиосульфат (иногда называют гипосульфит) натрия:
Nа2SО3 + S = Nа2S2О3,
содержащий тиосульфат-ион - производное от не выделенной в свободном виде тиосерной кислоты. Тиосульфат натрия содержит два атома серы в различных степенях окисления и проявляет восстановительные свойства.
Таким образом, SО2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
- Общая характеристика подгруппы азота.
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2 s2 2p3; P – 3 s2 3p3; As – 4 s2 4p3; Sb – 5 s2 5p3; Bi – 6 s2 6p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5, которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
- Аммиак. Получение, химические свойства. Применение.
В обычных условиях аммиак - бесцветный газ, легче воздуха, с резким запахом и едким вкусом. При -33,4°C он превращается в жидкость, которая затвердевает при -77,7°C. Аммиак очень хорошо растворим в воде, спирте, бензоле.
Используется аммиак в основном для производства азотной кислоты и азотных удобрений.
В промышленности аммиак получают непосредственным синтезом из азота и водорода в присутствии катализатора при высокой температуре и давлении:
N2 + 3H2 = 2NH3
Аммиак химически очень активен, особенно в реакциях окисления и присоединения. Молекула аммиака имеет пирамидальную форму, с основанием пирамиды из атомов водорода и атомом азота в вершине. Молекула NH3 поляризована - общие электронные пары сдвинуты к атому азота. Еще у атома азота есть неподеленная пара электронов, способных взаимодействовать по донорно-акцепторному механизму с ионами или молекулами, имеющими вакантные орбитали. Молекула аммиака присоединяет протон, образуя ион аммония, причем все четыре связи азота с водородом равноценны.
Аммиак - сильный восстановитель. Например, он взаимодействует с кислородом, образуя азот и воду:
4NH3 + 3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак окисляется до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
При нагревании с хлором и пероксидом водорода образуются молекулы свободного азота:
2NH3 + 3Cl2 = N2 + 6HCl
2NH3 + 3H2O2 = N2 + 6H2O
Водный раствор аммиака имеет щелочную реакцию, так как при растворении аммиака в воде образуется гидроксид аммония NH4OH, который диссоциирует:
NH4OH " NH+ + ОН-
Гидроксид аммония неустойчив и распадается на аммиак и воду:
NH4OH = NH3 + H2O
При нейтрализации раствора аммиака кислотами образуются соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Соли аммония хорошо растворимы в воде. Они очень похожи на соответствующие соли щелочных металлов, особенно на соли калия. Поэтому ион аммония - аналог ионов щелочных металлов.
Применение аммиака и его солей основано на специфических свойствах. Аммиак служит сырьём для производства азотосодержащих веществ, а также в составе солей широко применяется в качестве минеральных удобрений. Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
- Азотная кислота. Химические свойства. Взаимодействие с металлами. Нитраты. Обнаружение.
Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым запахом. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
4НNО3 = 4NО2 + 2Н2О + О2.
Азотная кислота принадлежит к числу наиболее сильных кислот и для нее характерны все реакции, в которые вступают кислоты, - с основаниями, основными оксидами и т.д.
Специфическим же свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NО3, имеющий в своем составе азот в степени окисления +5, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление анионаNО3- в связи с этим может протекать до различных веществ:
NO3- + 2H+ + 1e → NO2 + H2O, (1)
NO3- + 4H+ + 3e → NO + 2H2O, (2)
2NO3- + 10H+ + 8e → N2O + 5H2O, (3)
2NO3- + 12H+ + 10e → N2 + 6H2O, (4)
NO3- + 10H+ + 8e → NH4+ + 3H2O. (5)
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее НNО3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
Азотная кислота взаимодействует со всеми металлами, за исключением Аu, Рt, W. Концентрированная НNО3 не взаимодействует при обычных условиях также с Fе, Аl и Сr, которые она пассивирует, однако при очень сильном нагревании НNО3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NО2):
ЗР + НNО3 + 2Н2О = 3Н3РО4 + NО,
S + 2НNО3 = Н2SО4 + 2NО,
3C + 4НNО3 = 3СО2 + 4NО + 2Н2О,
ZnS + 8НNО3(конц) = ZnSО4 + 8NО2 + 4Н2O,
6НCl + 2НNO3(конц) = 3Сl2 + 2NО + 4Н2О. (6).
С помощью концентрированной НNО3 можно растворить даже золото. Для этого нужно взять смесь из одного объема концентрированной НNО3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
Аu + НNО3 + 4НСl = Н[АuСl4] + NO + 2Н2О.
Действие царской водки объясняется тем, что концентрированная НNО3 окисляет НСl по реакции (6) до свободного хлора, который в момент выделения является очень сильным окислителем. Поэтому при растворении металлов в царской водке получаются не соли азотной кислоты, а соответствующие хлориды.
- Азотистая кислота и ее соли. Роль в окислительно-восстановительных процессах. Применение.
Азотистая кислота НNО2 принадлежит к слабым кислотам (К = 6.10-4 при 25 °С), неустойчива и известна лишь в разбавленных растворах,в которых осуществляется равновесие
2НNО2  NО + NО2 + Н2О.
NО + NО2 + Н2О.
Нитриты в отличие от самой кислоты устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду.
- Биологическая роль азота и фосфора. Применение.
Азот по содержанию в организме человека (3,1%) от–носится к макроэлементам. Если учитывать только мас–су сухого вещества организма (без воды), то в клетках содержание азота составляет 8—10%. Этот элемент – составная часть аминокислот, белков, витаминов, гормо–нов. Азот образует полярные связи с атомами водорода и углерода в биомолекулах. Во многих бионеорганиче–ских комплексах (металлоферментах) атомы азота по донорно-акцепторному механизму связывают неорга–ническую и органическую части молекулы.
Вместе с кислородом и углеродом азот образует жиз–ненно важные соединения – аминокислоты, содержа–щие одновременно аминогруппу с основными свойст–вами и карбоксильную группу (—СООН) с кислотными свойствами. Аминогруппа выполняет очень важную функцию и в молекулах нуклеиновых кислот. Огромно физиологическое значение азотсодержащих биолиган-дов – порфиринов, например гемоглобина.
В биосфере происходит круговорот азота. Азотный цикл имеет жизненно важное значение для сельского хозяйства.
Необходимо отметить еще одно важное в биологиче–ском плане свойство азота – его растворимость в воде почти такая же, как у кислорода. Присутствие избытка азота в крови может быть причиной развития кессон–ной болезни. При быстром подъеме водолазов проис–ходит резкое падение давления, соответственно пада–ет растворимость азота в крови (закон Генри), и пузырьки элементного азота, выходящие из крови, закупоривают мелкие сосуды, что может привести к параличу и смерти.
По содержанию в организме человека (0,95%) фосфор относится к макроэлементам. Фосфор – элемент-органоген и играет исключительно важную роль в обме–не веществ. В форме фосфата фосфор представ–ляет собой необходимый компонент внутриклеточной АТФ. Он входит в состав белков (0,5—0,6%), нуклеиновых кислот, нуклеотидов и других биологически активных соединений. Фосфор является основой скелета живот–ных и человека (кальций ортофосфат, гидроксилапа-тит), зубов (гидроксилапатит, фторапатит).
Многие реакции биосинтеза осуществляются благода–ря переносу фосфатных групп от высокоэнергетического акцептора к низкоэнергетическому. Фосфатная буфер–ная система является одной из основных буферных сис-тем крови. Живые организмы не могут обходиться без фосфора. Значение фосфора состоит и в том, что сахара и жирные кислоты не могут быть использованы клетками в качестве источников энергии без предвари–тельного фосфорилирования.
Обмен фосфора в организме тесно связан с обменом кальция. Это подтверждается уменьшением количества неорганического фосфора при увеличении содержания кальция в крови (антагонизм).
Суточная потребность человека в фосфоре составляет 1,3 г. Фосфор настолько распространен в пищевых про–дуктах, что случаи его явной недостаточности (фосфат–ный голод) практически неизвестны. Однако далеко не весь фосфор, содержащийся в пищевых продуктах, мо–жет всасываться, поскольку его всасывание зависит от многих факторов: рН, соотношения между содержанием кальция и фосфора в пище, наличия в пище жирных кис–лот, но в первую очередь – от содержания витамина D.
Целый ряд соединений фосфора используют в качест–ве лекарственных препаратов.
Следует отметить, что фосфорорганические соедине–ния, содержащие связь С—Р, являются сильными нер–вно-паралитическими ядами, входят в состав боевых отравляющих веществ
- Мышьяк и его соединения. Обнаружение. Влияние на живой организм. Применение.
Мышья́к — химический элемент с атомным номером 33 в периодической системе, обозначается символом As. Представляет собой хрупкий полуметалл стального цвета.
Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс. Так русские химики называют элемент, ядовитые соединения которого задолго до его получения в чистом виде были известны древней Греции, Китаю и другим странам. За сильную, безотказную ядовитость для человека мышьяковистых соединений греки называли мышьяк "мужественным", "сильным". От такого значения греческих слов произошли латинское название и химический символ мышьяка - арсеникум (сильный).
Мышьяковистые соединения широко используются в стекольном, фарфоровом и фаянсовом производствах, при выделке кож и мехов. В сельском хозяйстве соединения мышьяка используются для борьбы с многочисленными вредителями сельскохозяйственных культур.
- Общая характеристика элементов подгруппы углерода. Влияние на живой организм. Применение.
В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева.Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств.
Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так

В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровнесвободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками).
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2.Степень окисления -4 в последовательности C – Pb становится все менее характерной.
| Свойства | С | Si | Ge | Sn | Pb |
| 1. Порядковый номер | |||||
| 2. Валентные электроны | 2s22p2 | 3s23р2 | 4s24р2 | 5s25р2 | 6s26р2 |
| 3. Энергия ионизации атома, эВ | 11,3 | 8,2 | 7,9 | 7,3 | 7,4 |
| 4. Относительная электроотрицательность | 2,50 | 1,74 | 2,02 | 1,72 | 1,55 |
| 5. Степень окисления в соединениях | +4, +2, -4 | +4, +2, -4 | +4, -4 | +4, +2, -4 | +4, +2, -4 |
| 6. Радиус атома, нм | 0,077 | 0,134 | 0,139 | 0,158 | 0,175 |
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения - формулы RН4.Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны,причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца.От углерода к свинцу уменьшается прочность водородных соединений RН4: СН4 - прочное вещество, а PbH4 в свободном виде не выделено.В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус, т. е.неметаллические свойства ослабевают, а металлические усиливаются.
Химические свойства углерода и кремния. Графит и кремний — типичные восстановители. При нагревании с избытком воздуха графит(именно этот аллотроп наиболее доступен) и кремний образуют диоксиды:
С + О2 = СО2,
Si + О2 = SiO2,
при недостатке кислорода можно получить монооксиды CO или SiO:
2С + О2 = 2СО,
2Si + O2 = 2SiO,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Si + SiO2 = 2SiO.
Уже при обычной температуре углерод и кремний реагируют со фтором, образуя тетрафториды СF4 и SiF4, при нагревании — с хлором, давая СCl4и SiCl4. При более сильном нагревании углерод и кремний реагируют с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
4Si + S8 = 4SiS2
и даже между собой, образуя карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод и кремний не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4НNО3 + 12НF = 3SiF4↑ + 4NO↑ +8Н2О.
Кроме того, кремний растворяется в водных растворах щелочей:
Si + 2NaОН + Н2О = Na2SiO3 + Н2↑.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод и кремний диспропорционируют, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
или силициды
2МgО + 3Si = Мg2Si + 2SiO.
Активные металлы — более сильные восстановители, чем углерод или кремний, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей
Са + 2С = СаС2,
2Mg + Si = Мg2Si.
- Кислородсодержащие соединения углерода. Цианиды.
Оксид углерода (II)
Оксид получают неполным окислением простых веществ или по реакциям: С + СО2 = 2СО. Не реагирует при обычных условиях ни с кислотами, ни со щелочами
Оксид углерода (II) – ядовитый газ без цвета и запаха, горит голубоватым пламенем, легче воздуха, температура кипения 81,63 К, температура плавления 68,03 К, плохо растворим в воде (2,3 объема СО на 100 объемов H2O при 293 К).
Оксид СО принято считать несолеобразующим, однако при пропускании его в расплав щелочи при высоком давлении непосредственно образуется соль в результате протекания окислительно-восстановительной реакции:
СО + КОН = НСООК.
Отсюда формально можно считать СО ангидридом муравьиной кислоты, что подтверждается обезвоживанием муравьиной кислоты:
 (*)
(*)
Следует, однако, обратить внимание, что в рассмотренных выше реакциях меняется степень окисления углерода +4 в муравьиной кислоте и в ее соли и +2 - в оксиде углерода (II) и эти реакции являются фактически окислительно-восстановительными. В то время как в реакциях соединения, характерных для "классических" солеобразующих оксидов, степень окисления элементов никогда не меняется, например:
СаО + СО2 = СаСО3.
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленнойпары электронов кислорода (изображена стрелкой):
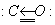
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
На воздухе СО горит голубоватым пламенем:
2СО + O2 = 2СO2.
При нагревании он восстанавливает металлы из их оксидов:
FеО + СО = Fе + СО2↑.
В присутствии катализатора или под действием облучения СО окисляется хлором, образуя ядовитый газ фосген:
СО + Сl2 = СОСl2.
При взаимодействии с парами воды идет обратимая реакция с образованием СО2 и водорода:
СО + Н2О  СО2 + Н2,
СО2 + Н2,
при нагревании с водородом при повышенном давлении образуется метиловый спирт:
СО + 2Н2  СН3ОН.
СН3ОН.
Со многими металлами СО образует летучие карбонилы:
Ni + 4СО = Ni(СО)4.
В природе оксид углерода (II) практически не встречается. В лаборатории его обычно получают обезвоживанием муравьиной кислоты по реакции (*).
Оксид углерода (II) может быть также получен при восстановлении оксида углерода (IV) углеродом или металлами:

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1362; Нарушение авторских прав?; Мы поможем в написании вашей работы!