
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кремний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si
|
|
|
|
Строение атома расскажешь по таблице Менделеева. И см. вопрос 18!!!!!!
Оксид получают неполным окислением простых веществ или по реакции Si + SiO2 = 2SiO. Не реагирует при обычных условиях ни с кислотами, ни со щелочами. Оксид кремния (II) мало доступен и очень редко используется.
Оксид кремния SiO2 - твердое, очень тугоплавкое вещество (температура плавления более 1700 °С), широко распространенное в природе, где оно встречается главным образом в виде минерала кварца, а также кристобалита и тридимита.
При обычных температурах устойчивой модификацией является кварц, с ростом температуры наблюдаются полиморфные превращения:
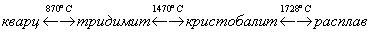
Кремнезем всех модификаций в виде мономера не существует; он всегда полимерен и «построен» из тетраэдров [SiO4], образующих очень прочную атомную решетку

Каждый атом кремния в кристаллах (SiO2)n тетраэдрически окружен четырьмя атомами кислорода, каждый из которых является мостиковым. Через общий атом кислорода тетраэдры [SiO4] под разными углами связываются друг с другом, образуя непрерывную трехмерную решетку; взаимное расположение тетраэдров [SiO4] в пространстве определяет ту или иную модификацию кремнезема.
В различных модификациях кремнезема прочность связей неодинакова. Это влияет на величину углов Si-О-Si и расстояний Si-О, например угол связи Si-О-Si в различных модификациях кремнезема изменяется от 120 до 180°. Переходы кварц-тридимит-кристобалитсопровождаются разрывом и преобразованием связей, что может происходить только при высоких температурах.
Кварц. Нередко встречается в природе в форме чрезвычайно хорошо образованных кристаллов, иногда значительной величины. Кристаллы образованы из тетраэдров, расположенных винтообразно вокруг центральной оси, в виде спирали. В одном и том же кристалле направление спирали может быть противоположным. Такие кристаллы являются оптическими изомерами. Они вращают плоскость поляризации света, причем могут быть как право-, так и левовращающими. Те и другие кристаллы отличаются как предмет от своего зеркального изображения.
Кварц используется в различных областях науки и техники, и его кристаллы часто выращиваются искусственно. Некоторые разновидности кварца носят особые названия. Прозрачные бесцветные кристаллы называют горным хрусталем. Встречаются и окрашенные разновидности кварца: розовый кварц, фиолетовый (аметист), темно-коричневый (дымчатый топаз), зеленый (хризопраз) и др. Мелкокристаллическая модификация кварца с примесями других веществ называется халцедоном. Разновидностями халцедона являются агат, яшма и др. Горный хрусталь и окрашенные разновидности кварца используют как драгоценные и полудрагоценные камни.
Тридимит встречается в вулканических породах, однако в очень небольших количествах. Известен тридимит и метеоритного происхождения.
Кристобалит в природе иногда встречается в виде мелких кристаллов, включенных в лаву, подобно тридимиту. Тридимит и кристобалитобладают более «рыхлой» структурой, нежели кварц. Так, плотность кристобалита, тридимита и кварца равна 2,32; 2,26 и 2,65 г/см3соответственно.
Расплав кремнезема при медленном охлаждении легко образует аморфное кварцевое стекло. Кремнезем в виде стекла встречается и в природе. Плотность аморфного стекла равна 2,20 г/см3 - ниже, чем у всех кристаллических модификаций. Кварцевое стекло имеет незначительный температурный коэффициент расширения, поэтому из него готовят лабораторную посуду, устойчивую к резким изменениям температуры.
Все модификации кремнезема в воде практически нерастворимы (при температуре 25 °С растворимость кварца составляет 7, кристобалита - 12, тридимита - 16, кварцевого стекла - 83 мг/л). Поэтому при обычных условиях на них действуют лишь растворы щелочей и плавиковая кислота:
SiO2 + 2КОН = К2SiO3 + Н2О, (1)
SiO2 + 4НF = SiF4↑ + 2Н2О. (2)
Последняя реакция используется при «травлении» стекла.
Приставленый диоксид кремния реагирует с основными оксидами, щелочами (реакция (1)) и карбонатами с образованием силикатов:
SiO2 + СаО = СaSiO3, (3)
SiO2 + Na2СО3 = Nа2SiO3 + СО2. (4)
Реакции (3) и (4) лежат в основе промышленного получения различных стекол, а также цемента. Так, состав обычного стекла (например, оконного, для изготовления посуды) выражается формулой Na2О.СаО.6SiO2. Такое стекло получают сплавлением смеси соды, песка и известняка. Процесс проводят при температуре ~1400 °С до полного удаления газов:
Na2СО3 + СаСО3 + 6SiO2 = Nа2О.СаО.6SiO2 + 2СО2↑.
Для получения специальных сортов стекла - огнеупорного, «небьющегося» - при варке добавляют оксиды бария, свинца, бора. Для получения цветных стекол вносят также различные добавки, например добавка оксида кобальта Со2О3 дает синий цвет, оксида хрома Сr2О3 - зеленый,двуоксида марганца МnО2 - розовый.
Оксид SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой хSiO2∙yН2O, где х и у - целые числа: 1) х = 1, у = 1: SiO2.Н2О, т.е. Н2SiO3 - метакремниевая кислота; 1) х = 1, y = 2: SiO2.2Н2О, т.е. ортокремниевая кислота; 1) x = 2, у = 1: 2SiO2.Н2О, т.е. Н2Si2O5 – двуметакремниевая кислота.
Кислоты, молекулы которых содержат более одной молекулы SiO2, относятся к поликремниевым.
Самая простая из кремниевых кислот - Н2SiO3, которую часто называют просто кремниевой, а ее соли - силикатами. Из силикатов в воде растворимы только силикаты натрия и калия, остальные силикаты - тугоплавкие, нерастворимые в воде вещества.
Растворы силикатов мутнеют при стоянии на воздухе, так как находящийся в нем СО2 вытесняет кремниевую кислоту из ее солей (Н2SiO3слабее угольной кислоты; константа диссоциации Н2SiO3 по первой ступени равна К1 = 2,2.10-10).
Н2SiO3 практически нерастворима в воде - это свойство используют как качественную реакцию для обнаружения силикат-ионов:
Na2SiO3 + СО2 + Н2О = Nа2СО3 + Н2SiO3↓.
Получают силикаты сплавлением SiO2 со щелочами или карбонатами.
Концентрированные растворы силикатов натрия и калия называют жидким стеклом, они имеют сильнощелочную реакцию вследствии того, что сильно гидролизованы:
К2SiO3 + Н2О  2КОН + Н2SiO3↓.
2КОН + Н2SiO3↓.
Жидкое стекло используют, например, для изготовления клея, водонепроницаемых тканей.
Цемент очень широко используется в строительстве как вяжущий материал, который при смешивании с водой затвердевает. Обычно цемент получают в больших вращающихся печах, где производят обжиг и размол различных силикатов (при температуре -1000 °С).
Различают несколько типов цементов, однако условно можно выделить два типа цементов по принципу их «свертывания» - обычный цемент ипортландский цемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция за счет углекислого газа воздуха:
СаО.SiO2 + СО2 + Н2О = СаСО3↓ + Н2SiO3↓.
При схватывании портландского цемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов:
Са3SiO5 + Н2О = Са2SiO4 + Са(ОН)2,
Са2SiO4 + 4Н2О = Са2SiO4.4Н2O↓.
- Общая характеристика элементов третьей группы главной подгруппы. Применение.
Алюминий — основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов — галлия, индия и таллия — напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2nр1 и могут проявлять степень окисления +3.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 875; Нарушение авторских прав?; Мы поможем в написании вашей работы!