
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовомеханическая теория атома водорода. Уравнение Шредингера для атома водорода, анализ его решения. Собственные значения энергии электрона в атоме. Потенциал ионизации
|
|
|
|
Уравнение Шредингера для атома водорода:
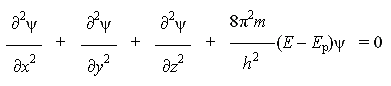
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, E p - потенциальная энергия электрона.
Анализ решения уравнения Шредингера дает следующие результаты:
1. Электрон в атоме может иметь только определенные дискретные (квантованные) значения энергии, которые совпадают с выражением
E=-(Z2me4/8ε02h2n2),
где n – главное квантовое число.
2. Орбитальный момент импульса L электрона в атоме также может принимать лишь ряд дискретных значений
L=(h/2π)√l(l+1),
Где l – орбитальное квантовое число.
3. Проекция орбитального момента импульса Lz на выбранное направление OZ (например, направление внешнего магнитного поля) тоже квантуется
Lz=(h/2π)m,
где m – магнитное квантовое число.
Потенциал ионизации - разность электрических потенциалов, ускоряющая электрон до энергии, равной работе ионизации. Потенциал ионизации измеряется в вольтах и является индивидуальной характеристикой вещества. Различают:
- первый потенциал ионизации, позволяющий оторвать один электрон от нейтрального невозбужденного атома;
- второй потенциал ионизации, позволяющий оторвать два электрона;
- третий потенциал ионизации, позволяющий оторвать два электрона и т.д.
(21). Полный набор квантовых чисел электронов в атоме, их физический смысл
Состояние электрона в атоме определяется набором четырех квантовых чисел, каждое из которых может принимать определенные значения:
Главное квантовое число: n = 1,2,3,…
Орбитальное квантовое число: l = 0,1,2,…,(n-1).
Магнитное квантовое число: m = 0,±1,±2,…,±l.
Спиновое квантовое число: ms = ±1/2
Физический смысл полного набора квантовых чисел электронов в атоме – порядковый номер электронного уровня, определение состояния электрона в атоме, описание электронных оболочек атомов. Каждый электрон в атоме имеет свой собственный «адрес», записанный набором четырех квантовых чисел.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2359; Нарушение авторских прав?; Мы поможем в написании вашей работы!