
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиты и неэлектролиты
|
|
|
|
Билет №5.
Электролиты и неэлектролиты. Электролическая диссоциация неорганическихкислот, солей, щелочей. Степень диссоциации. Электрический ток — направленное движение заряженных частиц под действиемвнешнего электромагнитного поля.Заряженные частицы:электроны — ток в металлах;ионы — ток в растворах. Электролиты — вещества, растворы которых проводят электрический ток:растворимые кислоты, щелочи, соли. Связь ионная или сильнополярная.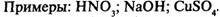 Неэлектролиты — вещества, растворы которых не проводят электрический ток:большинство органических веществ. Связь неполярная или слабополярная.
Неэлектролиты — вещества, растворы которых не проводят электрический ток:большинство органических веществ. Связь неполярная или слабополярная.  Электролитическая диссоциация Электролитическая диссоциация — распад электролита на ионы под действиемполярных молекул растворителя. Основы теории электролитической диссоциации – С.Аррениус, 1887г.:1. Электролиты при растворении в воде диссоциируют.2. Под действием электрического тока ионы движутся в растворе: положительнозаряженные - к катоду, отрицательно заряженные — к аноду.3. Диссоциация – обратимый процессВ молекуле воды связь ковалентная полярная, молекула угловая, следовательно,молекула воды — диполь.Причина диссоциации веществ с ионной связью: диполи воды разрушаюткристаллическую решетку.
Электролитическая диссоциация Электролитическая диссоциация — распад электролита на ионы под действиемполярных молекул растворителя. Основы теории электролитической диссоциации – С.Аррениус, 1887г.:1. Электролиты при растворении в воде диссоциируют.2. Под действием электрического тока ионы движутся в растворе: положительнозаряженные - к катоду, отрицательно заряженные — к аноду.3. Диссоциация – обратимый процессВ молекуле воды связь ковалентная полярная, молекула угловая, следовательно,молекула воды — диполь.Причина диссоциации веществ с ионной связью: диполи воды разрушаюткристаллическую решетку. 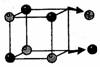 Причина диссоциации веществ с ковалентной полярной связью: молекулы водывызывают еще большую поляризацию связи вплоть до ее разрыва.
Причина диссоциации веществ с ковалентной полярной связью: молекулы водывызывают еще большую поляризацию связи вплоть до ее разрыва.  Степень диссоциации. Сильные и слабые электролиты Степень диссоциации — отношение числа распавшихся молекул к общему числумолекул растворенного вещества:
Степень диссоциации. Сильные и слабые электролиты Степень диссоциации — отношение числа распавшихся молекул к общему числумолекул растворенного вещества:  Если а ® 1, то электролит сильный. В растворе практически нет молекул.Примеры: НСl; NaOH; KBr.Если а ® 0, то электролит слабый. В растворе много молекул и мало ионов.Примеры: H2S; NH3; Fe(SCN)3.
Если а ® 1, то электролит сильный. В растворе практически нет молекул.Примеры: НСl; NaOH; KBr.Если а ® 0, то электролит слабый. В растворе много молекул и мало ионов.Примеры: H2S; NH3; Fe(SCN)3.|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1112; Нарушение авторских прав?; Мы поможем в написании вашей работы!