
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация кислот, щелочей и солей
|
|
|
|

 Основания — электролиты, в растворах которых нет других анионов, кромегидроксид-ионов.
Основания — электролиты, в растворах которых нет других анионов, кромегидроксид-ионов. 
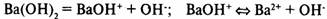 Соли — электролиты, в растворах которых есть катионы металлов или ионаммония и анионы кислотных остатков.
Соли — электролиты, в растворах которых есть катионы металлов или ионаммония и анионы кислотных остатков. 
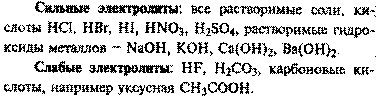
Билет №5. (углубленный)
Электролиты и неэлектролиты. Электролическая диссоциация неорганическихкислот, солей, щелочей. Степень диссоциации. Электролит проводит электрический ток в результате того, что направленноеперемещение его ионов создает поток электрических зарядов. Таким образом,пропускание электрического тока через электролит сопровождается переносомвещества.Электролитами чаще всего являются такие соединения, как кислоты, основания илисоли, находящиеся в расплавленном состоянии или в водных растворах.Способность электролитов проводить электрический ток называется электролитической проводимостью. Ее следует отличать от электроннойпроводимости обычных проводников электрического тока, например металлов. Ввеществах с электронной проводимостью поток заряда обусловлен потокомэлектронов, а не перемещением ионов. Поэтому пропускание электрического токачерез проводники с электронной проводимостью не сопровождается переносомвещества.Электролиты в свою очередь могут быть подразделены на два типа: сильные и слабыеэлектролиты. Сильный электролит – это соединение, которое врасплавленном состоянии или в растворе полностью ионизировано. Примеромсильного электролита может служить соляная кислота. При растворениихлороводорода в воде происходит его полная ионизация: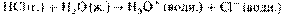 В этом уравнении использована простая (а не двойная) стрелка, чтобы показать,что процесс идет в указанную сторону до полного завершения. Слабый электролит – это вещество, которое диссоциирует на ионы лишьчастично. Следовательно, в растворе устанавливается равновесие междунедиссоциированными молекулами такого вещества и диссоциированными ионами.Примером слабого электролита является уксусная кислота:
В этом уравнении использована простая (а не двойная) стрелка, чтобы показать,что процесс идет в указанную сторону до полного завершения. Слабый электролит – это вещество, которое диссоциирует на ионы лишьчастично. Следовательно, в растворе устанавливается равновесие междунедиссоциированными молекулами такого вещества и диссоциированными ионами.Примером слабого электролита является уксусная кислота:  Органические кислоты и основания обычно являются слабыми электролитами. Неэлектролит вообще не диссоциирует на ионы и поэтому не обладаетспособностью проводить электрический ток. Большинство органических соединенийпринадлежат к неэлектролитам.Механизм электролитической диссоциации — распада молекул или кристалловрастворяемого вещества на ионы под влиянием молекул растворителя — былпонят несколько позднее. Согласно современным воззрениям, такой распадявляется результатом взаимодействия полярных молекул растворителя, напримерводы, с молекулами или кристаллической решеткой растворяемого вещества.Молекулы растворителя атакуют кристаллическую решетку, разрушая ее и переводясоставные части решетки (ионы) в раствор в форме сольватированных(гидратированных) заряженных частиц Окружающие эти ионы полярные молекулырастворителя ориентированы в соответствии с зарядом ионов. Растворениеэлектролита в известной мере упорядочивает молекулы растворителя. Естественнопредположить, что эта способность к упорядочению молекул растворителя умногозарядных ионов выражена сильнее, чем у однозарядных. В этом и нужно искатьпричину того, что соли, содержащие многозарядные ионы, плохо растворимы (в рядеслучаев практически нерастворимы) в воде. Например, хлорид бария растворимхорошо, а сульфат бария — очень плохо. Следовательно, влияние растворенноговещества и растворителя является обоюдным: полярные молекулы растворителяразрушают кристаллическую решетку растворяемого вещества на отдельные ионы, аэти ионы, переходя в раствор, вызывают изменение растворителя, заставляя егомолекулы упорядочиваться. Кроме того, сольватированные ионы растворенноговещества не индифферентны по отношению друг к другу. Противоположно заряженныеионы имеют тенденцию притягиваться силами электростатического взаимодействия,образуя нейтральные молекулы или нейтральные группы молекул. Разумеется, вреальном растворе всегда присутствуют как отдельные сольватированные ионы, таки нейтральные молекулы.
Органические кислоты и основания обычно являются слабыми электролитами. Неэлектролит вообще не диссоциирует на ионы и поэтому не обладаетспособностью проводить электрический ток. Большинство органических соединенийпринадлежат к неэлектролитам.Механизм электролитической диссоциации — распада молекул или кристалловрастворяемого вещества на ионы под влиянием молекул растворителя — былпонят несколько позднее. Согласно современным воззрениям, такой распадявляется результатом взаимодействия полярных молекул растворителя, напримерводы, с молекулами или кристаллической решеткой растворяемого вещества.Молекулы растворителя атакуют кристаллическую решетку, разрушая ее и переводясоставные части решетки (ионы) в раствор в форме сольватированных(гидратированных) заряженных частиц Окружающие эти ионы полярные молекулырастворителя ориентированы в соответствии с зарядом ионов. Растворениеэлектролита в известной мере упорядочивает молекулы растворителя. Естественнопредположить, что эта способность к упорядочению молекул растворителя умногозарядных ионов выражена сильнее, чем у однозарядных. В этом и нужно искатьпричину того, что соли, содержащие многозарядные ионы, плохо растворимы (в рядеслучаев практически нерастворимы) в воде. Например, хлорид бария растворимхорошо, а сульфат бария — очень плохо. Следовательно, влияние растворенноговещества и растворителя является обоюдным: полярные молекулы растворителяразрушают кристаллическую решетку растворяемого вещества на отдельные ионы, аэти ионы, переходя в раствор, вызывают изменение растворителя, заставляя егомолекулы упорядочиваться. Кроме того, сольватированные ионы растворенноговещества не индифферентны по отношению друг к другу. Противоположно заряженныеионы имеют тенденцию притягиваться силами электростатического взаимодействия,образуя нейтральные молекулы или нейтральные группы молекул. Разумеется, вреальном растворе всегда присутствуют как отдельные сольватированные ионы, таки нейтральные молекулы.  Действие растворителя на растворенное вещество настолько велико, что можетвызывать электролитическую диссоциацию веществ, не обладающих ионным типомсвязи. Например, полярные молекулы хлороводорода, растворяясь в воде,разрываются ее молекулами на ионы. При растворении хлороводорода в бензоле,являющемся менее полярным растворителем, чем вода, диссоциации молекул непроисходит. Поэтому раствор хлороводорода (кислота) в воде проводитэлектрический ток, а в бензоле нет. Степень электролитической диссоциации a – число, показывающее, какаячасть молекул электролита находится в растворе в виде ионов.Согласно этому определению
Действие растворителя на растворенное вещество настолько велико, что можетвызывать электролитическую диссоциацию веществ, не обладающих ионным типомсвязи. Например, полярные молекулы хлороводорода, растворяясь в воде,разрываются ее молекулами на ионы. При растворении хлороводорода в бензоле,являющемся менее полярным растворителем, чем вода, диссоциации молекул непроисходит. Поэтому раствор хлороводорода (кислота) в воде проводитэлектрический ток, а в бензоле нет. Степень электролитической диссоциации a – число, показывающее, какаячасть молекул электролита находится в растворе в виде ионов.Согласно этому определению 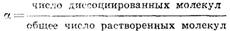 Очевидно, во всех растворах неэлектролитов, где диссоциация на ионы полностьюотсутствует, a=0, а в растворах, в которых все растворенное веществоприсутствует в форме ионов (полная диссоциация), a=1. Очень часто длярастворов средней и высокой концентраций (с»5,0%...с»10,0%) считают, чтослабые электролиты характеризуются a£0,03, а сильные – a³0,30.Электролиты средней силы характеризуются промежуточными значениями степенидиссоциации: 0,03£a£0,30. Однако необходимо отметить, чтопредложенная классификация является в значительной степени условной (особенно вслучае слабых электролитов и электролитов средней силы). Это объясняетсяследующим. Степень диссоциации в общем случае зависит от природы электролита ирастворителя, от концентрации и температуры раствора. Для растворов,образованных одними и теми же компонентами (растворителем и раствореннымвеществом), наибольший интерес представляет зависимость степени диссоциации отконцентрации раствора. Для слабых электролитов типа H+B– (кислота) или А+ОН– (основание) степень диссоциации ос иконцентрация раствора с связаны зависимостью:
Очевидно, во всех растворах неэлектролитов, где диссоциация на ионы полностьюотсутствует, a=0, а в растворах, в которых все растворенное веществоприсутствует в форме ионов (полная диссоциация), a=1. Очень часто длярастворов средней и высокой концентраций (с»5,0%...с»10,0%) считают, чтослабые электролиты характеризуются a£0,03, а сильные – a³0,30.Электролиты средней силы характеризуются промежуточными значениями степенидиссоциации: 0,03£a£0,30. Однако необходимо отметить, чтопредложенная классификация является в значительной степени условной (особенно вслучае слабых электролитов и электролитов средней силы). Это объясняетсяследующим. Степень диссоциации в общем случае зависит от природы электролита ирастворителя, от концентрации и температуры раствора. Для растворов,образованных одними и теми же компонентами (растворителем и раствореннымвеществом), наибольший интерес представляет зависимость степени диссоциации отконцентрации раствора. Для слабых электролитов типа H+B– (кислота) или А+ОН– (основание) степень диссоциации ос иконцентрация раствора с связаны зависимостью:  где Кi — константа, характеризующая способность того или иногослабого электролита к диссоциации.При малых значениях a (a£0,05) разность 1–a приблизительно равна 1. Тогдаиз этого уравнения можно получить:
где Кi — константа, характеризующая способность того или иногослабого электролита к диссоциации.При малых значениях a (a£0,05) разность 1–a приблизительно равна 1. Тогдаиз этого уравнения можно получить: 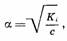 что является математическим выражением закона разведения Оствальда: степень диссоциации слабого электролита в растворе тем выше, чем более разбавленраствор. Допустим, что при растворении электролита ВА в воде образуется раствор, имеющийконцентрацию с. В результате некоторая часть а электролита ВА диссоциирует,образуя ионы B+ и А–. Величина a называется степеньюдиссоциации. Равновесная концентрация неионизированного электролита ВАоказывается равной с(1– a). Таким образом, можно записать
что является математическим выражением закона разведения Оствальда: степень диссоциации слабого электролита в растворе тем выше, чем более разбавленраствор. Допустим, что при растворении электролита ВА в воде образуется раствор, имеющийконцентрацию с. В результате некоторая часть а электролита ВА диссоциирует,образуя ионы B+ и А–. Величина a называется степеньюдиссоциации. Равновесная концентрация неионизированного электролита ВАоказывается равной с(1– a). Таким образом, можно записать  Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации 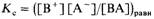 Подставив в это выражение равновесные концентрации участников диссоциации,получим
Подставив в это выражение равновесные концентрации участников диссоциации,получим  Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс называется константой диссоциации электролита. Чем больше Kc, тем сильнее электролит.
Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс называется константой диссоциации электролита. Чем больше Kc, тем сильнее электролит.|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!