
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовомеханичекая теория строения атома. Уравнение Шредингера. Волновая функция. Квантовые числа. Формы s -, р -, d - атомных орбиталей
|
|
|
|
Развитие представлений о строении атома. Модель атома Резерфорда. Теория Н. Бора. Уравнение волны Л. Де Бройля. Принцип неопределенности Гейзенберга. Квантовомеханичекая теория строения атома. Квантовые числа. Волновая функция
Обзор химических свойств элементов в периодической системе Д.И. Менделеева. Металлы и неметаллы. Основные породообразующие элементы.
Явление поляризации. Концентрационная и активационная поляризации. Механизм и способы их устранения.
Явление поляризации – при смещении потенциала электрода в положительную или в отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Отклонение потенциала электрода от его равновесного значения называется поляризацией
Концентрационная поляризация: протекание электродного процесса сопровождается изменением концентрации ионов электролита, участвующих в процессах электрохимического окисления или восстановления. Если ионы образуются в ходе электродного процесса, то их концентрация в приповерхностном слое электрода увеличивается, если они расходуются, то уменьшается. Тогда, например, при восстановлении ионов металла Меn + и уменьшении их концентрации, произойдет сдвиг электродного потенциала катода в область меньших значений. Это следует из уравнения Нернста:
φ = φ0 + (0, 059/n) • lg [Men +]
Аналогично, для анода произойдет сдвиг потенциала в область более высоких значений, так как прианодное пространство обогащается ионами. В результате напряжение гальванического элемента уменьшится и тем сильнее, чем больше величина тока. А при электролизе понадобится большая разность потенциалов, чем в условиях идеального перемешивания раствора. Такой вид поляризации электродов носит название - концентрационной поляризации.
Металлы – отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы -не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразные.
Обзор химических свойств элементов в периодической системе Д.И. Менделеева: в периодической системе элементы расположены в таком порядке, что с лева на право неметаллические свойства возрастают а с низу вверх металлические свойства возрастают. ным ъ потенциала измерить невозможно.) от природы веществ, участников электродного процесса, 2) от о ачестве этолона принято считатьстандартный водородный электод(тенциалы. м. ановителем
Наличие в атоме массивного, но малого по размерам (по сравнению с атомом) положительного электрического заряда – ядра.( см, размер атома
см, размер атома  см). Исходя из этого Резерфорд построил планетарную модель атома (в центре атома находится положительно заряженное массивное ядро, а легкие отрицательные заряды (электроны) вращаются по различным орбиталям вокруг этого ядра.)
см). Исходя из этого Резерфорд построил планетарную модель атома (в центре атома находится положительно заряженное массивное ядро, а легкие отрицательные заряды (электроны) вращаются по различным орбиталям вокруг этого ядра.)
Первый постулат Бора: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия. В стационарных состояниях атом не излучает. Второй постулат: При переходе атома из одного стационарного состояния в другое, излучается или поглощается квант с энергией, равной разности энергий этих состояний.
Де Бройль предположил, что двойственной природой обладает не только свет, но и любой мат. объект. Длина волны любого движущегося объекта: 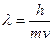 . В случае наблюдения за объектами микромира: воздействие на них фотона (для определения координаты), ее скорость меняется.
. В случае наблюдения за объектами микромира: воздействие на них фотона (для определения координаты), ее скорость меняется.
Принцип Гейзенберга: Невозможно одновременно точно определить координаты частицы и ее импульс.  (аналогично y, z). Где дельты – погрешность определения координат, погрешность определения проекций импульса на оси координат. Для волн Де Бройля:
(аналогично y, z). Где дельты – погрешность определения координат, погрешность определения проекций импульса на оси координат. Для волн Де Бройля:  , где вторая пси-амплитуда волн Де Бройля (координатная волновая функция).
, где вторая пси-амплитуда волн Де Бройля (координатная волновая функция).
Квантово-механическая модель атома не обладает наглядностью. Законы движения частиц в квантовой механике выражаются уравнением Шредингера. Уравнение, связывающее энергию системы с ее волновым движением. Стационарное уравнение Шредингера для одной частицы:  , где U – пот. энергия частицы, E – ее полная энергия.
, где U – пот. энергия частицы, E – ее полная энергия.  -вероятность нахождения частицы в данном месте пространства. Для волн Де Бройля:
-вероятность нахождения частицы в данном месте пространства. Для волн Де Бройля:  , где вторая пси-амплитуда волн Де Бройля (координатная волновая функция).
, где вторая пси-амплитуда волн Де Бройля (координатная волновая функция).
В квантовой механике каждая АО характеризуется 3-мя квантовыми числами. Главное квантовое число n может принимать целочисленные значения от 1 до бесконечности. Оно определяет номер энергетического уровня, интервал энергий электронов, находящихся на данном уровне, размеры орбиталей, число подуровней данного энергетического уровня, в ПСЭ max значению n соответствует номер периода. Орбитальное квантовое число l определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать целочисленные значении от 0…n-1. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение (s, p, d, f). Магнитное квантовое число m определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве. Принимает отрицательные и положительные значения l, включая 0. Общее число значений = 2l+1. От значения m зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. В общем случае m характеризует ориентацию АО в пространстве относительно внешней силы. Общее число возможных значений m соотв. числу способов расположения орбиталей данного подуровня в пространстве, т.е. общему числу орбиталей на данном подуровне.
S-орбитали имеют форму сферы(характеризуются l=0, m=0), P-орбитали – гантели(объемные восьмерки) – l=1, m=-1,0,1. (3 АО, расположенных вдоль осей координат). d-подуровень – l=2, m=-2,-1,0,1,2. 5АО, dxy,dxz,dyz,dx*2-y*2, dz*2.
Собственный момент импульса электрона – спин. Может принимать только значение = ½. Проекция вектора спина на опред. направление внешнего поля наз. спиновым квантовым числом, ms=+-1/2. Спин – проявление релятивистских эффектов на микроскопическом уровне.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 542; Нарушение авторских прав?; Мы поможем в написании вашей работы!