
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Заслуги Вишневского в развитии местной анестезии 1 страница
|
|
|
|
.
28.Явление поляризации: химическая и концентрационная (на конкретных примерах). Физические и химические деполяризаторы.(стр.37)
ЭДС работающего гальванического элемента всегда меньше теоретически рассчитанной. Это обусловлено поляризацией электродов – явление смещения велич Поляризация, вызванная изменением химической природы электрода, называется химической.
Для уменьшения поляризации используется физическая деполяризация: перемешивание раствора, механическое удаление газа; а также химические деполяризаторы: вещества, вступающие в реакцию с продуктами, обусловливающими поляризацию. Например, химическая поляризация, вызванная выделением водорода, снижается под действием сильных окислителей (K2Cr2O7, MnO2, O2 и др.). Так, в элементе Вольта при добавлении в катодное пространство K2Cr2O7 протекает окислительно-восстановительная реакция
K2Cr2O7 + 4 H2SO4 + 3 H2 = Cr2(SO4)3 + K2SO4 + 7 H2O,
в ионной форме
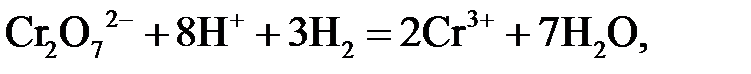
в результате водород окисляется и выводится из сферы электродной реакции, что приводит к увеличению ЭДС.
29.Зависимость φрэл-да от концентрации потенциал определяющих ионов. Концентрационные гальванические элементы.
Гальванический элемент – электрохимическое устройство, в котором самопроизвольно протекает окислительно-восстановительная реакция; при этом процессы окисления и восстановления пространственно разделены и происходят в двойном электрическом слое у электродов, находящихся в замкнутом контуре.
Зависимость величин электродных потенциалов от природы электродов и концентрации потенциалопределяющих ионов обусловливает существование химических и концентрационных гальванических элементов
Концентрационный гальванический элемент – элемент, у которого оба электрода одинаковой природы в растворах с различной концентрацией ионов. Работает элемент за счет выравнивания концентрации растворов.
Например: концентрационный элемент составлен из двух металлических электродов
А(–) Ni │ NiSO4║NiSO4│Ni (+)К
C1 < C2
А:  ,
,
K:  .
.
Возникающая при этом ЭДС зависит от соотношения концентраций ионов
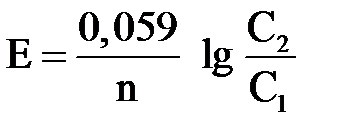 , ,
| (3.12) |
где С1 и С2 – молярные концентрации ионов у анода и катода (C1 < C2).
30.Процессы электролиза. Факторы, влияющие на скорость разряда частиц на электродах. Поляризация и перенапряжение при электролизе, ЭДС разложения электролита.
Простейшая электролизная система состоит из электролизера (электролитическая ванна), электродов (инертных или активных), электролита (раствора или расплава), источника постоянного тока. Электрод, подключенный к отрицательному полюсу источника тока – катод, к положительному – анод.
31.Законы Фарадея. Электрохимический эквивалент. Выход по току (Вт).(стр.37)
Количественные характеристики процессов электролиза устанавливаются законами Фарадея.
1-й закон Фарадея – массы (объемы) веществ, претерпевших изменения на электродах, прямо пропорциональны количеству прошедшего электричества:
 или или 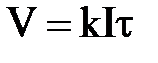 , ,
| (3.13) |
где k – коэффициент пропорциональности, при этом k = m, если Q =1 Кл; m (V) – массы (объемы) веществ, претерпевших превращения, г (л); I – сила тока, А; τ – время прохождения тока, с.
2-й закон Фарадея – одинаковые количества электричества преобразуют эквивалентные количества веществ:
 или или 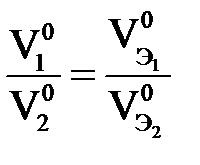 или или 
| (3.14) |
где  и
и 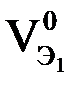 ,
,  – эквивалентные массы и эквивалентные объемы(н.у.) веществ, претерпевших превращения.
– эквивалентные массы и эквивалентные объемы(н.у.) веществ, претерпевших превращения.
Примечание. Для вычисления эквивалентных объемов газообразных веществ необходимо сравнить их мольную и эквивалентную массы. Во сколько раз эквивалентная масса меньше мольной, во столько раз эквивалентный объем меньше мольного объема (22,4 л). Эквивалентный объем водорода равен 11,2 л, эквивалентный объем кислорода равен 5,6 л.
Из второго закона Фарадея следует, что при Q = F = 96 500 Кл, m = Э или  , тогда
, тогда
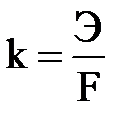 или или 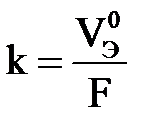 , ,
| (3.15) |
где k – электрохимический эквивалент вещества, г/Кл или л/Кл.
Отсюда можно записать уравнение, объединяющее 1-й и 2-й законы
Фарадея:
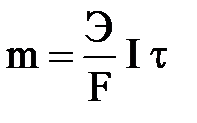 или или 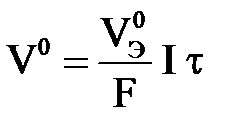 . .
| (3.16) |
Следует заметить, что количества веществ, полученных практически, всегда меньше рассчитанных, что численно характеризуется величиной выхода по току (ВТ), при этом ВТ < 1.
 или или  . .
| (3.17) |
С учетом выхода по току (ВТ) уравнения (3.16) примут вид
 или или  . .
| (3.18) |
Снижение выхода по току обусловлено различными причинами, важнейшими из которых являются поляризация и перенапряжение при прохождении тока.
32.Правила электролиза водных растворов электролиты на инертных электродах (на конкретных примерах).
33.Электролиз водных растворов электролитов на активных (растворимых) анодах. Использование в гальванотехнике и электрорафинировании металлов.
34.Электролиз растворов, использование для получения активных металлов I группы (на примерах).
35.Коррозия металлов и её классификация по характеру коррозионной среды и по механизму протекания коррозионных процессов.
Коррозия – самопроизвольный процесс разрушения металлов под воздействием окружающей среды. Критерием самопроизвольности процессов коррозии является термодинамическая нестабильность металлов и уменьшение свободной энергии Гиббса (∆ G) при переходе их в окисленное состояние.
Скоростькоррозии зависит отактивности металла, характера коррозионной среды, условий взаимодействия с ней и природы продуктов коррозии.
В зависимости от условий протекания коррозия бывает: атмосферная, почвенная, в среде электролита. По механизму протекания коррозионных процессов различаютхимическую и электрохимическую коррозию.
Химическая коррозия протекает без возникновения электрического тока: газовая – в газах или парах без конденсата влаги на поверхности металла (окисление О2, Cl2 и т.д. при высоких температурах); жидкостная – в растворах неэлектролитов (органические жидкости). Основные продукты химической коррозии – оксидные пленки, пассивирующие поверхность металлов.
Электрохимическая коррозия – это окисление металлов в среде электролита с возникновением электрического тока.
Причины электрохимической коррозии: контакт металлов, различных по химической природе; наличие примесей в структуре конструкционного материала; неоднородность металлов по химическому и фазовому составу, наличие нарушенных оксидных или других пленок; контакт в одном изделии участков, подвергшихся различной термической или механической обработке и др.
В результате в присутствии электролита возникают короткозамкнутые макро‑ или микрогальванические элементы,в которых протекаетанодное окисление металла с катодным восстановлением окислителя окружающей среды. Анодомявляется металл с меньшим значением j;катодные участки – это металл или примесные центры с большим значением j. В результате окисления анода электроны перемещаются к катодным участкам и поляризуют их, т.е.уменьшают их потенциалы. Окислитель среды, связывающий эти электроны,называется деполяризатором. Если окислителем (деполяризатором) являются ионы Н+, коррозия протекает с водородной деполяризацией по схеме
А: Ме – n  = Меn+,
= Меn+, 
К: 2Н+ + 2  = Н2, при рН < 7,
= Н2, при рН < 7,
2Н2О + 2  = Н2 + 2OH–, при рН ≥ 7,
= Н2 + 2OH–, при рН ≥ 7, 
С водородной деполяризацией корродируют металлы высокой химической активности с низкими значениями потенциала.
Если окислителем (деполяризатором) является O2, коррозия протекает с кислородной деполяризацией по схеме
А: Ме – n  = Меn+,
= Меn+, 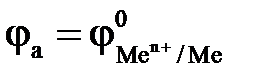
К: O2 + 4Н+ + 4  = 2Н2O, при рН < 7,
= 2Н2O, при рН < 7,
O2 + 2Н2О + 4  = 4OH–, при рН ≥ 7,
= 4OH–, при рН ≥ 7, 
С кислородной деполяризацией корродируют все металлы, за исключением благородных или пассивирующихся.
Условия самопроизвольного протекания коррозии:
электрохимическое – Е > О;
термодинамическое –  G = – n·F·E < 0.
G = – n·F·E < 0.
Скорость электрохимической коррозиизависит от активности металла, величины рН электролита, присутствия активаторов коррозии (О2, Cl- и др.), температуры, природы катодных участков и др. Скорость коррозии с водородной деполяризацией может быть замедлена снижением температуры, увеличением рН, очисткой металлов от примесей, катализирующих выделение Н2 (Со, Ni, Pt и др.). При кислородной деполяризации скорость коррозии замедляется при уменьшении концентрации О2 (деаэрация), снижении его парциального давления, введении в электролит восстановителя.
Активирующее действие ионов Сl- (соленые почвы, морская вода и др.) объясняется их высокой адсорбируемостью на поверхности металлов, разрушением пассивирующих оксидных пленок или предотвращением их образования. Особенно большое влияние оказывают ионы Cl- на коррозию Al, Cr, Fe, Ni и др. Кроме того, все металлы, за исключением Ag, Рb, образуют хорошо растворимые хлориды, что также способствует коррозии.
И наоборот, вторичные реакции, приводящие к образованию, например, основных гидроксидов Fe(ОН)2 или Fe(OH)3, труднорастворимых в нейтральной или щелочной средах, тормозят коррозионные процессы. Гидроксиды же амфотерных металлов (Zn, Cr, Sn, Al и др.) нерастворимы только в нейтральных средах, поэтому для таких металлов опасны не только кислая, но и щелочная среды.
Пример. Рассмотрим термодинамическую возможность коррозии стальной детали с медными заклепками в условиях влажной атмосферы (Н2О, О2), рН = 7.
В результате контакта Fe с Cu возникает короткозамкнутый гальванический элемент по схеме
е
Fe H2O, O2 Cu
pH = 7
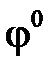 , B –0,44+0,34
, B –0,44+0,34
A: 
 B;
B;
K: 
 B.
B.
Возникающая при этом ЭДС равна  В,
В,
Так как  G = – n F E < 0, то коррозия стальных изделий в таких условиях термодинамически возможна. Но скорость коррозии снижается со временем вследствие вторичных реакций образования малорастворимых в нейтральной и щелочной средах основных гидроксидов железа и образования ржавчины:
G = – n F E < 0, то коррозия стальных изделий в таких условиях термодинамически возможна. Но скорость коррозии снижается со временем вследствие вторичных реакций образования малорастворимых в нейтральной и щелочной средах основных гидроксидов железа и образования ржавчины:

 – ржавчина.
– ржавчина.
Для борьбы с коррозией разрабатываются разнообразные способы защиты, выбор которых зависит от природы защищаемого металла, вида и габаритов изделий или оборудования, условий их эксплуатации, природы коррозионной среды и т.д. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (неметаллические и металлические); в) электрохимическая защита (протекторная и электрозащита); г) изменение свойств коррозионной среды.
==================================
36. Гальванокоррозия. Условия образования макро- и микрогальванических коррозионных элементов. Уравнения анодно-катодных реакций.
37. Коррозия с водородной и кислородной деполяризацией. Критерии протекания процессов э/х коррозии.
Электрохимическая коррозия – процесс самопроизвольного анодного окисления металла и катодного восстановления окислителя среды в результате образования на поверхности металла короткозамкнутых гальванических элементов (гальванопар).
Причины:
Контакт металлов, различных по хим природе, наличиеп примесей в структуре конструкционного материала, неоднородность металлов по хим и фазовому составу, наличие нарушенных оксидных или других плёнок, контакт в одном изделии участков, подвергшихся различной термической или механической обработке.
Механизм:
В процессе коррозии электрода гальванопары поляризуются вследствие перехода электронов с анода на катод. Поляризация уравнивает потенциалы анодного и катодного участков, всякий процесс катодного восстановления, повышающий потенциал катода, является деполяризацией.
По характеру катодного процесса различают коррозию с водородной и кислородной деполяризацией. Водородная деполяризация: 2H+ +2e=H2 при pH<7, 2H2O+2e=H2+2OH‾ при pH>=7. Кислородная деполяризация: О2 + 4Н+ +4е = 2Н2О при рН<7, О2+2Н2О+4е=4ОН‾ при рН>=7.
Скорость э/х коррозии Зависит от природы металла, характера коррозионной среды, величины pH электролита, наличия активаторов коррозии, наличие ингибиторов коррозии, природы катодных участков, температуры, природы вторичных продуктов коррозии.
Скорость коррозии с водородной деполяризацией снижается очисткой металлов от примесей, катализирующих выделение Н2; увеличением рН, снижением температуры. Скорость коррозии с поглощением кислорода снижается деаэрацией электролита, снижением давления кислорода, введением в электролит восстановителя.
38. Методы защиты от коррозии. Защитные покрытия неметаллические и металлические; катодные и анодные.
Остановимся подробнее на отдельных из перечисленных методов защиты.
Неметаллические защитные покрытия. Они могут быть как органическими (лаки, краски, смолы, полимерные пленки и др.), так и неорганическими (эмали, соединения хрома, фосфора и др.).
Оксидирование, химическое и электрохимическое (анодирование) – образование на поверхности металлов пассивирующих оксидных пленок.
Анодное оксидирование (анодирование) широко используется для повышения коррозионной стойкости таких металлов, как Al, Ti, Ta, Nb. Такие защитные пленки имеют высокую твердость, эластичность, электросопротивление (1014 Ом×см). Анодирование используется для получения изолирующих слоев на лентах, применяемых в электрических конденсаторах и других устройствах. При анодировании алюминия электролитом служат растворы хромовой, серной, щавелевой или лимонной кислот. Катодом выбирают металл, не взаимодействующий с электролитом, чаще всего свинец или сталь, анодом – изделие из алюминия.
Схему для получения анодированного алюминия можно представить в виде
| К (–) Pb H2SO4, H2O Al (+) A |
| – + |
H+ SO42–
H2O H2O
K: 12H+ + 12e = 6H2; A: 6H2O – 12e = 3O2 + 12H+.
4Al + 3O2 = 2Al2O3.
Металлические покрытия: анодные – металл покрытия имеет меньший потенциал, чем защищаемый. В случае нарушения целостности анодного покрытия возникает гальванический элемент, в котором анодом служит покрытие и корродирует, а изделие является катодом и не подвергается коррозии. Катодные покрытия – металл покрытия имеет больший потенциал, чем защищаемый. В случае повреждения катодного покрытия защищаемый металл служит анодом в образующемся гальваническом элементе и коррозия его усиливается, а покрытие является катодом и не подвергается коррозии. Более надежным является анодное покрытие.
Неметаллические защитные покрытия. Они могут быть как органическими (лаки, краски, смолы, полимерные пленки и др.), так и неорганическими (эмали, соединения хрома, фосфора и др.).
Оксидирование, химическое и электрохимическое (анодирование) – образование на поверхности металлов пассивирующих оксидных пленок.
Анодное оксидирование (анодирование) широко используется для повышения коррозионной стойкости таких металлов, как Al, Ti, Ta, Nb. Такие защитные пленки имеют высокую твердость, эластичность, электросопротивление (1014 Ом×см). Анодирование используется для получения изолирующих слоев на лентах, применяемых в электрических конденсаторах и других устройствах. При анодировании алюминия электролитом служат растворы хромовой, серной, щавелевой или лимонной кислот. Катодом выбирают металл, не взаимодействующий с электролитом, чаще всего свинец или сталь, анодом – изделие из алюминия.
Схему для получения анодированного алюминия можно представить в виде
| К (–) Pb H2SO4, H2O Al (+) A |
| – + |
H+ SO42–
H2O H2O
K: 12H+ + 12e = 6H2; A: 6H2O – 12e = 3O2 + 12H+.
4Al + 3O2 = 2Al2O3.
39.Электрохимические процессы защиты: протекторная- и электрозащита (на конкретных примерах).
электрохимическая защита: протекторная, катодная.
Протекторная: присоединение к защищаемой конструкции протектора – металла более активного чем защищаемый. В качестве материала для анодов-протекторов широко используются магний в виде его сплавов. Принципиальным недостатком защиты является низкая ЭДС, что ограничивает применение протекторов в плохопроводящих средах, безвозвратные потери металла и возможное загрязнение окружающей среды.
40. Применение э/х процессов в технике. Химические источники тока (ХИТ): первичные, необратимого действия.
41.Обратимые ХИТ многократного действия: кислотные (свинцовые) и щелочные. Схемы, уравнения электродных реакций.
42.ХИТ непрерывного действия: топливные элементы Н2 – О2: щелочные и килотные.
Инфильтрационная анестезия соединяет в себе положительные качества инфильтрационной и проводниковой анестезии. Ангатомич метод основан на особенностях строения фациальных образ. Раствор анестезирующего ве-ва, вводимый под
давлением в эти футляры, распространяется в них и проникает к нервам и нервным окончаниям. Тугие прокаиновые инфильтраты ползут по футлярам и сливаются между собой. Обезболивание проводит хирург в процессе операции, пользуясь попеременно, по мере рассечения слоя тканей, шприцом и скальпелем. Инфильтрацию тк нужно осуществлять до вскрытия футляра, так как при рассечении или случайном повреждении раствор анестезирующего ве-ва будет выливаться в рану, вследствие чего создать плотный ползучий инфильтрат будет невозможно, и добиться достаточного обезболивающего эффекта. Тугая инфильтрация препарирует тк обезболивающим раствором- винфильтрате легко опред сосуды, нерв- позволяет избежать их повреждения, облегчает остановку кровотечения. Для инфильтрационной- используют 0,25% Ра-ры прокаина или лидокаина с добавлением эпинефрина. Пример-обезболивание щит.железы: 2шприца; для обезболивания кожы, рас-р вводят тонкой иглой в\к, создавая «лимонные корочки» по все линии разреза кожи. Ч\з инфильтрационную кожу вводят прокаин в подкожную клетчатку. Рассекают кожу, подкож.клетчатку,, подкодные мыш шеи, обезболив рас-р вводят по средней линии, инфильтрирую мыш, и затем-под мыш в направлении кверху, книзу и в стороны. После рассечения и выпихивания в рану щит.железы проводят дополнительную инфильтрацию обезболивающим Ра-ром тк у верхнего и нижнего полюсов железы и по зад ее поверхности.
2. Гемолитические осложнения при переливании крови.
Нарушение правил переливания, недоучет противопоказаний, погрешности в технике трансфузии могут привести к посттрансфузионным осложнениям.
Осложнения могут не сопровождаться серьезными нарушениями функций органов и систем и не представлять опасности для жизни- пирогенные (легки - температура повыш в пределах 1, головная боль, боль в мыш, средние -озноб,повыш на 2,5-2градуса, учащение пульсаи дыхание, тяж -потрясающий озноб, температура тела повышается больше чем на2градуса, выраженная головная боль, боль в мыш, костях, одышка, цианоз губ, тахикардия)причина-продукты распада белков плазмы и лейкоцитов донорской крови, продукты жизнедеятельности микробов(больного необходимо согреть, укыть одеялом, приложить грелки к ногам, напоить горяч чаем) и легкие аллергические ре-ции (следсвие сенсибилизации организма к Ig. Проявления повыш температуры, озноб, общ недомогание, крапивница, одышка, удушье, ташнота, рвота. Для лечения применяют антигистаминные и десенсибилизирующие средства- хлоропирамин, глюкокортикостероиды). Развиваются вскоре после трансфузии и выражаются в повышении температуры тела, общем недомогании, слабости, может появиться озноб, головная боль, зуд кожи, отек отдельных частей тела.
При переливании несовместимой в Аг отношении крови развивается гемотрансфузионный шок. Основные причины несовместимости крови — ошибки в действиях врача, нарушение правил переливания. Периоды: собственно гемотрансфузионный шок; период олигурии и анурии, снижение диуреза и развитие уремии, продолжительность 1,5-2нед; восстановление диуреза-полиурия и уменьшение азотемии, продолжительность 2-3нед; выздоровление- в течение 1-3мес.Клинические симптомы шока могут возникнуть в начале, после переливания 10-30мл крови, в конце трансфузии или в ближайшее время. Бактериально- токсический шок –инфицированние крови во время заготовки или хранения. Осложнения возникают во время или ч/з30-60мин после нее. Воздушная эмболия – при нарушении техники переливания- неправильном заполнении системы для трансфузии, несвоевременном прекращении переливангия крови под давлением. Клинич.признаки- резкая боль в груди, одышка, сильный кашель, цианоз верхней половины туловища, слабый часты пульс, падение АД. Тромбоэмболия- в результате эмболии сгустками, образовавшимися при ее хранении, или тромбами, оторвавшимися из тромбированной вены при переливании в нее крови. Острое расширение сердца - быстрое поступление в кровь больного больших доз консервированной крови при струйном ее переливании или нагнетании под давлением. Возникает одышка, цианоз, частый малый ритмичный пульс, повышение АД. Цитратная интоксикация-массивная гемотрансфузия. Токсич дозой цитрата натрия-0,3г/кг. Инфекционные осложнения - перенос с кровью острых инфекционных заболеваний, передача заболеваний, распространяющихся сывороточным путем.
3. Если рана нанесена в асептических условиях и технически правильно (все, что соприкасалось с раной и что в ней оставлено (швы, лигатуры), было стерильно, ткани соединены послойно и правильно, не оставлено кровоточащих сосудов, гематомы) требуется покой, защита от инфекции со стороны окружающих тканей и соприкасающихся с ней нестерильных предметов, например, белья, для чего накладывается небольшая асептическая повязка. Лечение свежих инфицированных ран - случайные раны, считаются всегда инфицированными. Необходимо избегать внесения вторичной инфекции. Первая помощь заключается в наложении асептической повязки после смазывания окружности раны йодной настойкой, а в дальнейшем, в срочной операции, т. е. первичной обработке раны. Первичная хирургическая обработка раны состоит в иссечении краев и дна раны. Если имеются карманы или рана узкая и глубокая, предварительно производят рассечение. Зашивание раны применяется, если состояние раны и больного позволяет это, а также при наличии воспалительных явлений. Иссечение производится, начиная с краев кожи в глубину, в пределах макроскопически здоровой ткани с сохранением крупных сосудов или нервов.Все обработанные раны должны быть дренированы рыхло размещенными марлевыми тампонами, резиновыми полосками или трубками с применением антисептиков (1,5—2% хлорамин). Хирургическая обработка производится в чистой операционной при наличии стерильного белья, стерильного материала и достаточного количества инструментов (несколько скальпелей, пинцетов, артериальных зажимов, крючков для расширения раны) обязательно на операционном столе и под обезболиванием Лечение гнойных ран, развивающихся после повреждений, ведется по методам, которыми пользуются при лечении гнойных воспалительных процессов. Лечение проводится различно в первый и второй период раневого (воспалительного) процесса. а) удалить секвестр, инородные тела, б) создать отток раневого секрета, гноя, крови, лимфы из раны, ее карманов, щелей, в) создать покой раны, г) содействовать гиперемии. Надо рассечь имеющиеся карманы, затеки и отслойки, удалить распадающиеся, омертвевшие ткани. Гиперемия достигается применением грелок, суховоздушных или горячих ванн, смотря по локализации и степени ранения. Согревающие компрессы не рекомендуются, так как они задерживают испарение из повязки, нарушают ток жидкости из глубины раны, ведут к задержке и обратному всасыванию отделяемого, к ухудшению общего состояния организма. Для усиления всасывающего действия повязки, для дезинфекции раны и раздражения тканевых элементов применяются осмотические, антисептические средства в виде жидких растворов, мазей и порошков.
Билет24
1. Проводниковая анестезия: виды, средства, показания, техника выполнения. Местная анестезия – обратимое устранение болевой чувствительности в определенной части тела, вызванное действием специальных лекарственных средств. Проводниковая анестезия. Разделяют следующие ее виды: анестезия нервных стволов, анестезия нервных сплетений, анестезия нервных узлов (паравертебральная), спинномозговая и эпидуральная (перидуральная) анестезия. Анестетик вводят пери- или эндоневрально. Проводниковая анестезия пальца по Лукашевичу-Оберсту применяется при операциях на пальце (при панарициях, ранах, опухолях). Накладывают резиновый жгут, дистальнее которого на тыльной поверхности основной фаланги анестезируют кожу, подкожную клетчатку и далее продвигают иглу до кости вводят 2-3 мл 1—2% раствора новокаина. Межреберная анестезия –используется при переломах ребер. Отступив на несколько см от перелома ребра по направлению к позвоночнику, анестезируют кожу путем в/к введения рас-ра прокаина из шприца с иглой. Перпендикулярно к сломанному ребру в месте анестезии кожи вкалывают иглу и при ее продвижении до упора в ребро медленно вводят прокаин, оттянув иглу на 2-3мм, ее концом смещают мягкие тк, продвигают иглу к нижнему краю ребра, соскальзывая по ее поверхности, и вводят периневрально 3-5мл 1-2%рас-ра прокаина, лидокаина, не вынимая иглы, возвращают ее на наружную поверхность ребра, продвигают путем соскальзывания к верхнему краю и вводят2-3мл 1-2% рас-ра прокаина, иглу извлекают. Анестезию плечевого сплетения по Куленкампфу – применяютпри операциях на верхней конечности. Положение больного на спине, голова повернута в противоположную сторону, рука свободно свисает со стола. Длинную иглу, без шприца после инфильтрации кожи рас-ом прокаина вводят кнаружи от места пульсации артерии на 1см выше ключицы, и скользя по верхнему краю 1ребра, продвигаются кверху в направлении остистых отростков1и2грудных позвонков и доходят до сплетения.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 663; Нарушение авторских прав?; Мы поможем в написании вашей работы!