
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Види жовтяниць
|
|
|
|
Причинами виникнення гіпербілірубінемії і розвитку жовтяниць є надмірне утворення білірубіну в організмі, пошкодження печінки з порушенням її детоксикаційної та екскреторної функцій або наявність механічних перешкод у системі жовчовивідних шляхів, що протидіють нормальному виведенню жовчі в кишечник. Розрізняють кілька типів жовтяниць.
Передпечінкова {гемолітична) жовтяниця — розвивається внаслідок патологічно підсиленого руйнування (гемолізу) еритроцитів та розщеплення гемоглобіну і надмірного накопичення в крові білірубіну. Причинами такого стану можуть бути резус-конфлікт у новонароджених, переливання несумісної крові, радіаційне ураження, дія гемотоксичних отрут. збільшення концентрації в крові
загального білірубіну, переважно за рахунок непрямої фракції
Печінкова {паренхіматозна) жовтяниця — розвивається внаслідок порушення
структури та ферментативних властивостей гепатоцитів в результаті дії пошкоджуючих
факторів вірусного, бактеріального, хімічного походження. значна гіпербілірубінемія
(збільшення концентрації загального білірубіну) Зростання в крові прямого білірубіну
Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі.
Ферментативні (спадкові) жовтяниці - виникають внаслідок генетичних ен-
зимопатій, що спричинені порушеннями експресії генів, які відповідають за синтез у
гепатоцитах ферментів кон'югації білірубіну його абсорбції
з крові або екскреції в жовч.
3. Вітаміни – органічні харчові речовини (ну-и-ну, даже стихами говорят)
Вітаміни - біоорганічні сполуки, що є життєво необхідними компонентами обміну речовин; вітаміни не синтезуються в організмі людини як інші біомолекули, а надходять з компонентами харчування. На відміну від таких поживних речовин, як вуглеводи, ліпіди та білки, вітаміни належать до мікрокомпонентів харчування: їх добові потреби для людини складають міліграмові або мікрограмові кількості. Водорозчинні вітаміни
Вітамін В] (тіамін; антиневритний вітамін).
Вітамін В2 (рибофлавін).
Вітамін РР (вітамін В а ніацин; антипелагричний вітамін).
Вітамін В6 (піридоксин; антидерматитний вітамін).
Вітамін Вп (кобаламін; антианемічний вітамін).
Фолієва кислота (птероїлглутамат; антианемічний вітамін).
Вітамін Н(біотин; антисеборейний вітамін).
Пантотенова кислота (вітамін EL; антидерматитний вітамін).
Вітамін С (аскорбінова кислота).
Вітамін Р (вітамін проникності).
Жиророзчинні вітаміни
Вітамін А (ретинол; аксерофтол; вітамін росту).
Вітамін К (філохінон; антигеморагічний вітамін).
Вітамін Е (а-токоферол; вітамін розмноження).
Вітамін F (комплекс поліненасичених жирних кислот).
Вітамін D (кальциферол; антирахітний вітамін).
Вітамінна недостатність - стан, що розвивається внаслідок зменшення (або відсутності) певного вітаміну в організмі. Вітамінна недостатність супроводжується важкими розладами біохімічних та фізіологічних процесів і виникненням специфічної патології.
4. Молекулярні механізми м’язового скорочення та розслаблення м’язів
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
Головним біохімічним регулятором скорочення та розслаблення м'язів є зміни цитозольноїконцентрації іонів Са2+, яка у стані спокою (розслаблення) становить близько 10"8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулуму, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секве-стрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10~5 моль/л, що ініціює молекулярні процеси, які є м'язовим скороченням.
5. Енергетичний обмін в головному мозку людини. Значення аеробного окислення глюкози.
Загальний хімічний склад головного мозку характеризється наявністю білків (близько 8 % загальної маси тканин), значною кількістю ліпідів (10-12 %), вуглеводів (близько 1 %), інших низькомолекулярних біомолекул, неорганічних солей і води (77-78 %). надзвичайно високому вмісті ліпідів різноманітної хімічної структури. Біоенергетика мозку характеризується значною залежністю від постачання киснем, який використовується переважно на аеробне окислення глюкози. Основним споживачем метаболічної енергії в головному мозку, що використовується у формі АТФ, є процес генерації нервового потенціалу на мембрані нейронів, який вимагає постійного функціонування натрієвого насоса - мембранної Na+, К+-АТФази. Головною особливістю енергетичного обміну головного мозку є значне переважання рівня використання глюкози над іншими субстратами енергетичного обміну. У тканині головного мозку в реакції гідролітичного дезамінування АМФ постійно утворюється вільний аміак, який знешкоджується шляхом взаємодії з глутаматом, утворюючи глутамін, що виходить у кров.
6. Схема синтезу ІМФ
(1) взаємодія а-0-рибозо-5-фосфату з АТФ з утворенням 5-фосфорибозил-1-піро-
фосфату (ФРПФ);
(2) взаємодія ФРПФ із глутаміном з утворенням 5-фосфорибозиламіну;
(3) взаємодія 5-фосфорибозиламіну з гліцином з утворенням гліцинамід-рибозил-5-
фосфату (ГАР); о
(4) взаємодія ГАР з активною формою форміату (—С—Н) (К5,К10-метеніл-Н4-фо-
латом) з утворенням форміл-ГАР;
(5) взаємодія форміл-ГАР з глутаміном (донором аміногрупи) з утворенням форміл-
гліцинамідин-рибозил-5-фосфату(форміл-ГАМ);
(6) взаємодія форміл-ГАМ з АТФ із замиканням імідазольного кільця, тобто
утворенням сполуки, що містить п'ятичленне кільце пуринового циклу - аміноімідазол-
рибозил-5-фосфату (АІР);
(7) карбоксилування АІР з утворенням аміноімідазолкарбоксилат-рибозил-5-фос-
фату (АІКР);
(8) взаємодія АІКР із аспартатом (донором аміногрупи) з утворенням проміжної
сполуки - аміноімідазолсукцинілкарбоксамід-рибозил-5-фосфату (АІСКР);
(9) розщеплення АІСКР з елімінацією фумарату та утворенням аміноімідазолкарбо-
ксамід-рибозил-5-фосфату (АІКАР); О
(10) форматування АІКАР за рахунок (—С—Н)-групи №°-форміл-Н4-фолату з
утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР);
(11) дегідратація та циклізація ФАІКАР з утворенням першого пуринового нуклео-
тиду - інозинмонофосфорної (інозинової) кислоти, (ІМФ).
Білет 6
1. Мікросомальне окислення і реакції кон’югації в печінці. Компоненти окислення. Роль цитохрома Р-450
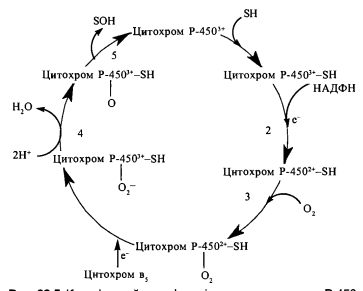 1 фаза — окислювально-відновлювальні та гідролітичні реакції, що каталізуються мембранозв'язаними ферментами ендоплазматичного ретикулуму гєпатоцитів ("мікро- сомальними ферментами"). У результаті реакцій першої фази у складі субстратів біотрансформації утворюються функціональні групи -ОН, -СООН, -SH, -NH2; таким чином, ці реакції (функціоналізації, або прекон 'югації) призводять до збільшення полярності молекули ксенобіотика або ендогенного субстрату (наприклад, стероїду).
1 фаза — окислювально-відновлювальні та гідролітичні реакції, що каталізуються мембранозв'язаними ферментами ендоплазматичного ретикулуму гєпатоцитів ("мікро- сомальними ферментами"). У результаті реакцій першої фази у складі субстратів біотрансформації утворюються функціональні групи -ОН, -СООН, -SH, -NH2; таким чином, ці реакції (функціоналізації, або прекон 'югації) призводять до збільшення полярності молекули ксенобіотика або ендогенного субстрату (наприклад, стероїду).
2 фаза — реакції синтезу, або кон'югації, що ґрунтуються на приєднанні до молекулярних продуктів 1-ї фази (або вихідних субстратів, що вже мали у своєму складі полярні функціональні групи) залишків глюкуронової, сірчаної кислот, гліцину, глутаміну, глутатіону, метильного або ацетильного радикалів.
1) окислювальне гідроксилування аліфатичних сполук: 1а - алканів та алкенів:
R-CH3»-R-CH2OH
1 б - алкільних бічних ланцюгів циклічних сполук, наприклад:
С,Н,-СН, ►С,Н,-СН,ОН
2) окислювальне гідроксилування циклічних сполук
3) окислювальне дезалкілування,
4) реакції відновлення
Цитохром Р-450 гемопротеїн залежно від ізоформи, який має спектр поглинання СО-комплексу при 450 нм. виявлено близько 500 ізоформ цитохрому-450, що розрізняються за своєю субстратною специфічністю, особливостями первинної структури та фізико-хімічних властивостей. каталізі реакцій окислювального гідроксилування, що мають місце при синтезі і біотрансформації ендогенних гідрофобних сполук ліпідної природи, а саме - холестерину, фізіологічно активних стероїдів, жовчних кислот та деяких інших природних ліпідів, зокрема метаболізмі ейкозаноїдів.
Реакції кон 'югації в гепатоцитах
Реакції кон'югації з утворенням "парних" сполук - шлях детоксикації більшості ксенобіотиків, що мають функціональні групи -ОН, -СООН, -NH2, -SH. 1. Реакціїглюкуронування (УДФ), УДФ-глюкуронілтрансфераза, 2. Реакції сульфування, донором NH2
сульфатних радикалів у яких є біологічно активна форма сірчаної кислоти - 3'-фосфоаденозин-5'-фосфосульфат (ФАФС). 3. Реакції метилування та ацетилування - поширений тип кон'югації, якому підлягають як ксенобіотики, так і ендогенні субстрати; в цих реакціях беруть участь S-аденозилметіонін (О-метилування) та ацетил-КоА (N-ацетилування): 4. Реакції кон 'югації з гліцином. Поширеною реакцією є утворення гіпурової кислоти при взаємодії ендогенної амінокислоти гліцину із введеною в організм бензойною кислотою:
2. Розпад гема. Жовчні пігменти.
1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і
супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці"
2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину.
3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою
4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням.
5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів;
3. Молекулярні механізми м’язового скорочення та розслаблення м’язів
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
Головним біохімічним регулятором скорочення та розслаблення м'язів є зміни цитозольноїконцентрації іонів Са2+, яка у стані спокою (розслаблення) становить близько 10"8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулуму, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секве-стрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10~5 моль/л, що ініціює молекулярні процеси, які є м'язовим скороченням.
4. Всмоктування вуглеводів. Порушення травлення і всмоктування.
Основні реакції розщеплення вуглеводів відбуваються в тонкому кишечнику за рахунок дії ферментів підшлункової залози, що потрапляють у порожнину дванадцятипалої кишки, і власних ферментів кишкового соку.
Панкреатична а-амілаза - це ендоглікозидаза, подібна до ферменту слини, яка гідролізує крохмаль та глікоген з утворенням суміші розгалужених і нерозгалужених олігосахаридів і деякої кількості мальтози і мальтотріози.
Р-амілаза - панкреатична екзоглікозидаза, яка відщеплює від нерозгалужених гомополісахаридних ланцюгів залишки мальтози.
Дисахаридази та олігосахаридази - ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування:
мальтоза (а-глюкозидаза) - фермент, що гідролізує мальтозу та відщеплює термінальні глюкозні залишки з нередукуючих кінців сс(1-»-4)-зв'язаних олігосахаридів;
мальтаза та ізомальтаза (а(1-»-6)-глікозидаза) завершують розщеплення гомополісахаридів, розпочате амілазами;
лактаза ф-галактозидаза) — фермент, що розщеплює лактозу (молочний цукор) до двох моносахаридів - галактози та глюкози; надзвичайно велике фізіологічне значення лактази в харчуванні дітей;
сахараза ф-фруктозидаза) - фермент кишечного соку, що гідролізує з утворенням глюкози і фруктози дисахарид сахарозу - основний компонент бурякового та тростинного цукру.
утворюється суміш моносахаридів, які всмоктуються клітинами кишкового епітелію і надходять у
кров.
Недостатність дисахаридаз
порушеннями у перетравлюванні та всмоктуванні відповідних цукрів.
Недостатність лактази
неспроможності кишкового соку розщеплювати молочний цукор і позначається як непереносимість лактози. зустрічається у вигляді низької активності лактази. Ця форма непереносимості лактози успадковується як автосомна рецесивна патологія і вперше проявляється в підлітковому періоді або у молодому віці.
Недостатність сахарози звичайно виявляється разом із недостатністю ізо-
мальтази у вигляді поєднаного дефекту - непереносимості двох дисахаридів. Ферментопатія проявляється після переводу новонароджених на мішане харчування з додаванням фруктових соків та інших продуктів, що містять рослинні цукри. вуглеводної диспепсії - діареєю, метеоризмом; новонароджені діти відстають у розвитку.
5. Класифікація гормонів: за місцем синтезу, хімічною природою, механізмом дії.
Гормони - фізіологічно активні сполуки (ФАС), що продукуються залозами внутрішньої секреції (ендокринними залозами) або іншими спеціалізованими клітинами і діють як сигнальні молекули та біорегулятори метаболічних процесів та фізіологічних функцій в організмі. Біологічні ефекти гормонів здійснюються у надзвичайно низьких концентраціях. Гормони, що синтезуються в ендокринних залозах ("справжні", істинні гормони), секретуються в кров'яне русло
і після перенесення спеціалізованими транспортними білками здійснюють свої біологічні ефекти, як правило, на відстані, тобто діють на віддалений чутливий орган або органи.
До "справжніх" гормонів належать:
- гормони гіпоталамуса та гіпофіза;
- гормони щитовидної залози;
- гормони паращитовидної залози;
-гормони ендокринних клітин підшлункової залози;
-гормони коркової частини надниркових залоз;
- гормони чоловічих та жіночих статевих залоз;
- гормони епіфіза.
Хімічна структура гормонів За хімічною будовою всі гормони поділяють на такі класи:
(1) білково-пептидні гормони (прості білки; глікопротеїни; пептиди): гіпоталамо-гіпофізарні гормони; гормони паращитовидної залози; гормони острівкової частини підшлункової залози; гастроінтестинальні гормони; нейропептиди; численні тканинні біорегулятори пептидної природи;
(2) гормони - похідні амінокислот: гормони щитовидної залози; гормоноїди мозкової частини надниркових залоз (катехоламіни); інші нейромедіатори з властивостями гістогормонів (серотонін, дофамін, гістамін); гормон епіфіза - мелатонін;
(3) гормони стероїдної природи: глюкокортикоїди та мінералокортикоїди кори надниркових залоз; чоловічі та жіночі статеві гормони; похідні вітаміну D;
(4) біорегулятори - похідні арахідонової кислоти (ейкозаноїди): простагландини, простацикліни, тромбоксани, лейкотрієни, ліпоксини.
6. Біосинтез піримідинових нуклеотидів


Білет 7
1. Жіночі статеві гормони. Механізм дії
До жіночих статевих гормонів належать:
естрогени - похідні естрану (С18-стероїди);
прогестагени - похідні прегнану (С2І-стеро'їди).
Діють естрогени шляхом зміни синтезу білків у клітині, хоча можуть надавати і зовнішньорецепторний ефект. Механізм дії. Е. вибірково накопичуються в органах-мішенях — матці, піхві, молочних залозах, передній частці гіпофіза, печінці, де зв’язуються зі специфічним позаядерним білком естрофіліном, рецепторами плазматичних мембран клітин-мішеней, утворюючи з ними гормон-рецепторні комплекси. Вони проникають у ядро, активують синтез ДНК і РНК, впливають на синтез білка.
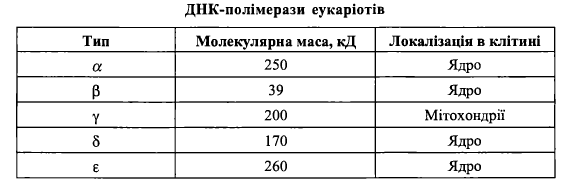
2. Загальна схема біосинтезу ДНК. Ферменти реплікації ДНК у прокаріотів та еукаріотів.
Було встановлено, що в цих умовах синтезується певна кількість нової ДНК (точніше, полідезоксирибонуклеотиду), до складу якого входили дезоксинуклео- зидмонофосфати (дНМФ) із складу дНТФ, що були використані для біосинтезу. При цьому новий ланцюг ДНК утворювався за рахунок приєднання дНМФ до кінця одного з ланцюгів ДНК, що вже існувала (передіснуючої ДНК). Особливості синтезу ДНК в ДНК-полімеразній системі:
- ДНК-полімераза не може синтезувати повністю новий ланцюг ДНК, а спроможна лише приєднувати дНМФ до вже існуючого ланцюга;
- синтез нового ланцюга ДНК відбувається в напрямку 5'-3', тобто ДНК-поліме- раза послідовно приєднує нуклеотиди (дНМФ з наявних дНТФ) до 3'-кінця одного з ланцюгів ДНК ("ланцюга-затравки");
- для синтезу нового ланцюга ДНК необхідний також ланцюг-матриця; нуклеотиди сполучаються з З'-кінцем "ланцюга-затравки" відповідно до нуклеотидної послідовності в "ланцюгу-матриці" (тобто, за принципом комплементарності).
Ферменти біосинтезу ДНК у прокаріотів:
1) ДНК-полімераза І - білок з м.м. 103 кДа. Біохімічні функції:
5'—>3' - полімеразна активність (розглянута вище);
5'—>3' - екзонуклеазна активність (тобто спроможність видаляти нуклеотиди вище від напрямку синтезу);
З'—»5' - екзонуклеазна активність ("коригуюча" активність, або спроможність видаляти вже включений нуклеотид, якщо він включений помилково, тобто не є комплементарним ланцюга-матриці);
2) ДНК-полімераза II (білок з м.м. 120 кДа) не є основним в реплікації ДНК у прокаріотів; за існуючими уявленнями, переважною функцією цього ферменту є участь у репарації ДНК;
3) ДНК-полімераза III- головний фермент, що реалізує процес елонгації ДНК у Е. соїі.
|
|
|
|
|
Дата добавления: 2015-05-08; Просмотров: 664; Нарушение авторских прав?; Мы поможем в написании вашей работы!