
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Електропровідність розчинів електролітів
|
|
|
|
Розчини електролітів належать до провідників другого роду. Згідно з теорією Арреніуса, молекули електролітів у водному розчині дисоціюють на заряджені частинки – йони, які переносять електрику. Не всі електроліти дисоціюють в однаковій мірі: одні – сильні електроліти – дисоціюють у розчині повністю; інші – слабкі електроліти – дисоціюють частково. Електрична провідність слабких електролітів визначається, в основному, ступенем дисоціації, який залежить від концентрації електроліту і температури. На провідність сильних електролітів впливає йонна атмосфера, яка при накладенні зовнішнього поля викликає появу двох ефектів, що гальмують рух йона в розчині: релаксаційного і електрофоретичного.
Електричну провідність мають не тільки водні, але й неводні розчини. Провідність неводних розчинів також визначається концентрацією йонів і швидкістю їх руху.
Розрізняють питому і молярну електричну провідність.
Питома електрична провідність (κ або "χ" – гр. "капа") – це величина, обернена питомому опору ρ:
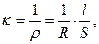
де R – опір провідника; l – його довжина; S – площа перерізу.
Таким чином, питома електрична провідність – це електропровідність 1 м3 розчину електроліту, розміщеного між двома електродами, що мають площу 1 м2 і віддалені один від одного на 1 м. Розмірність питомої електричної провідності:[k] = Ом-1 м-1 = См ∙ м-1.
Питома електропровідність залежить від концентрації електроліту і від сили електроліту. Так, зі збільшенням концентрації електроліту k збільшується, досягаючи певного максимального значення і при подальшому збільшенні концентрації електропровідність зменшується. Електропровідність залежить від температури і її підвищення призводить до зростання електропровідності.
Залежність від концентрації виражається молярною (еквівалентною)електропровідністю (λ). Це електропровідність об’єму розчину м3, в якому розчинений 1 моль електроліту, розміщеного між електродами, відстань між якими дорівнює 1 м. Розраховують молярну електропровідність за формулою:
λ = κ∙V або λ = κ /С,
де V – розведення (об'єм розчину, у якому міститься 1 моль речовини), м3; С – молярна концентрація, моль/ м3.
Розмірність l: 
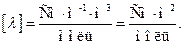
Молярна електрична провідність слабких і сильних електролітів спочатку збільшується з розведенням (для слабких електролітів унаслідок зростання їх ступеня дисоціації, для сильних – у результаті зменшення міжйонної взаємодії), а потім перестає змінюватися, досягаючи межі, при якій вона стає незалежною від концентрації. Така електрична провідність називається молярною електричною провідністю при нескінченному розведенні λ∞.
Згідно із законом незалежності руху йонів (закон Кольрауша ):
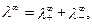
де λ∞+ і λ∞– – йонні електричні провідності при нескінченному розведенні.
Йонні електричні провідності пропорційні рухливостям йонів:

де F – число Фарадея, яке дорівнює 96484,56 Кл ∙ моль–1; u+ і u– – рухливості йонів, що залежать від природи йона, розчинника і температури.
Значення рухливостей йонів у водних розчинах при нескінченному розведенні та температурі 298 К дуже невеликі та коливаються від 4,0∙10–8 до 3,6∙10–7 м2∙с–1 В–1. Максимальну рухливість мають водневий і гідроксильний йони.
Для розведених розчинів сильних електролітів при розрахунку залежності молярної електричної провідності від концентрації застосовують рівняння Кольрауша:
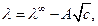
де А – константа, що залежить від температури і природи розчинника.
Вимірювання електропровідності дозволяє встановити ступінь дисоціації:
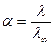 .
.
Ввівши співвідношення 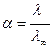 у формулу розбавлення Оствальда для константи дисоціації слабких електролітів, дістанемо:
у формулу розбавлення Оствальда для константи дисоціації слабких електролітів, дістанемо:
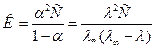 .
.
Дослідження електропровідності різних розчинів дає можливість визначити ступені і константи дисоціації слабких електролітів, рН розчинів (кондуктометричне титрування) розчинність важкорозчинних солей, вивчати кінетику електрохімічних реакцій.
Електропровідність різних тканин і біологічних рідин неоднакова. Добре проводять струм спинно-мозкова рідина, лімфа, кров. Нижча електропровідність тканин легень, серця, печінки. Дуже низька електропровідність у жирової і кісткової тканини. За визначенням питомої електропровідності сечі можна визначити наявність в ній неелектролітів – глюкози, цукру. Отже, при різних патологіях спостерігається відхилення електропровідності від норми.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 17024; Нарушение авторских прав?; Мы поможем в написании вашей работы!