
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв'язування задач
|
|
|
|
Задача 1. Для 0,015 М розчину масляної кислоти С2Н7СООН при 25 °С виміряний опір становить 2210 Ом. Обчислити ступінь і константу йонізації цієї кислоти, а також концентрацію йонів Н+та рК, якщо постійна електродної комірки становить 40м-1, а гранична електропровідність йонів Н+ і С3Н7СОО- 0,0350 і 0,004 См·м2/моль відповідно.
розв'язування. За даними задачі обчислюємо:
1. Питому електропровідність χ розчину масляної кислоти
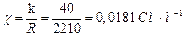 .
.
2. Молярну електропровідність λ:
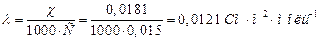 .
.
3. Граничну молярну електричну провідність λ∞:
λ∞ = λН++ λС3Н7СОО- = 0,0350 + 0,0040 = 0,0390 См·м2·моль-1.
4. Ступінь йонізації α для кислоти:
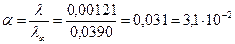 .
.
5. Константу йонізації К і рК:
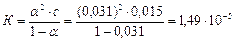 .
.
рK = –lgK = –(lg1,49·10-5) = –(0,173–5,0) = 4,827 ≈ 4,8.
6. Концентрацію йонів [Н+]:
[Н+]=С·α=0,015·3,1·10-2 = 4,65·10-4 моль/л.
Задача 2. Знайти розчинність, добуток розчинності для солі Ag3PO4 за такими даними експерименту: постійна електродної комірки k = 95,5 м-1, опір дистильованої води та насиченого розчину Ag3PO4 при 25 °С становив 15,4·106 і 5,99·105 Ом відповідно. Гранична молярна електропровідність йонів у цих умовах становить (См·м2·моль-1): λAg+ = 0,0035, λPO43- = 0,00473.
розв'язування. Визначаємо питому електропровідність дистильованої води:
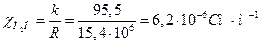 .
.
Аналогічно розраховуємо питому електропровідність для насиченого розчину важкорозчинної солі Ag3PO4:
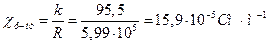 .
.
Обчислюємо питому електропровідність солі:
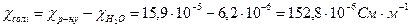 .
.
Визначаємо граничну молярну електропровідність солі:
λ∞ = λAg+ + λPO43- = 0,00535 + 0,00473 = 0,0108 См·м2·моль-1.
Одержана величина практично співпадає з молярною електропровідністю λсолі. Обчислюємо молярну концентрацією С із формули:
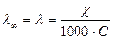 .
.
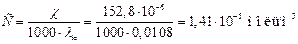 .
.
Переведемо визначену концентрацію всього електроліту на концентрацію його різних йонів:
[йонів] = С/валентність.
[Ag+] = С/1= 1,41·10-5 моль/ м 3;
[РО43-] = С/3=1,41·10-5/3=4,7·10-6 моль/ м 3.
Знаючи, що ця сіль дисоціює за схемою: Ag3PO4  3 Ag++ PO43-, обчислюємо добуток розчинності:
3 Ag++ PO43-, обчислюємо добуток розчинності:
ДР= [Ag+]3·[РО43-] = (1,41·10-5)3·4,7·10-6 = 1,32·10-20.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1116; Нарушение авторских прав?; Мы поможем в написании вашей работы!