
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приклади розв'язування задач
|
|
|
|
Задача 1. Як зміниться рН буферного розчину після додавання 30 см3 0,2 М розчину NaOH до суміші, що складалась із 100 см3 0,1 М розчину СН3СООН та 200 см3 0,2 М CH3COONa? (Ксн3соон = 1,78·10-5).
Розв’язування. За формулою Гендерсона – Гассельбаха обчислимо рН буферного розчину:
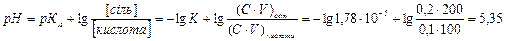 .
.
Знайдемо кількість ммоль доданого лугу:
n = С·V = 0,2·30 = 6 ммоль NaOH.
Визначаємо, як зміниться склад буферного розчину після додавання 6 ммоль NaOH. Зрозуміло, що луг зменшив на 6 ммоль кількість слабкої кислоти, яку він нейтралізує. У результаті на 6 ммоль збільшиться кількість солі в буферному розчині:
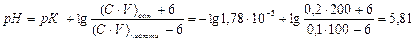 .
.
Тоді рН буферного розчину зміниться на:
ΔрН = 5,81 – 5,35 = 0,46.
Отже, після додавання лугу рН буферного розчину збільшується на 0,46.
Задача 2. Обчислити значення коефіцієнта активності 0,01 Мрозчину хлоридної кислоти.
Розв'язування. Йонну силу електроліту визначаємо за рівнянням:
І = 1/2 (с1z12 + с2z22 + с3z32 +... сіzі2);
І = 1/2 (с1z12 + с2z22)=1/2(0,01·12+0,01·12)=0,01.
Коефіцієнт активності обчислюємо за формулою:
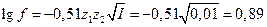 .
.
Відповідь: f± = 0,89.
Задача 3. Обчислити концентрацію йонів і недисоційованих молекул в 0,1 М розчині оцтової кислоти і константу її дисоціації при 291 К, якщо ступінь дисоціації кислоти дорівнює 0,0132.
Розв'язування. Обчислюємо константу дисоціації оцтової кислоти
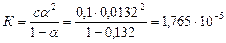 .
.
Концентрації йонів і недисоційованих молекул оцтової кислоти відповідно становитимуть:
Сн+ = αс = 0,0132·0,1 = 0,00132 моль/дм3;
ССН3СОО - = αс = 0,0132·0,1 = 0,00132 моль/дм3;
ССН3СООН = (1 – α)c= 0,9868·0,1 =0,09868 моль/дм3.
Відповідь: 0,00132 моль/дм3; 0,00132 моль/дм3; 0,09868 моль/дм3.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 620; Нарушение авторских прав?; Мы поможем в написании вашей работы!