
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізм процесу дисоціації
|
|
|
|
Дисоціюють речовини з йонним і ковалентним полярним зв’язком. Наприклад, кристал солі NaCl, молекула кислоти НСl.
Коли кристал солі, гратка якого утворена з йонів, потрапляє в воду, то його йони притягують до себе полярні молекули води, які орієнтуються біля йонів своїми протилежно зарядженими полюсами. Між йонами і диполями води виникають сили взаємного притягання (йон-дипольна взаємодія), в результаті зв’язок між йонами послаблюється, відбувається дисоціація на гідратовані йони:

Рис. 24. Схема електролітичної дисоціації натрій хлориду в водному розчині
При дисоціації полярних молекул молекули води притягаються до кінців полярної молекули своїми протилежно зарядженими полюсами (диполь-дипольна - взаємодія) і спричиняють розход-ження її полюсів – поляризують молекулу. В результаті такої диполь-дипольної взаємодії електронна пара повністю зміщується до атома з більшою електронегативністю, полярна молекула перетворюється в йонну і легко розпадається на гідратовані йони (рис. 25).
Процес дисоціації хлоридної кислоти схематично можна вира-зити рівнянням:

Йон гідрогену Н+ міцно зв’язується з молекулою води в йон:
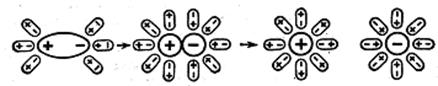
а б в г
Рис. 25. Схема електролітичної дисоціації полярної молекули під дією розчинника: а- полярна молекула на початку гідратації;
б – перехід полярної структури в йонну під дією диполів води;
в – гідратований катіон; г – гідратований аніон
гідроксонію за донорно-акцепторним механізмом:
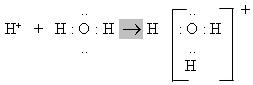
Для спрощення в рівняннях дисоціації звичайно пишуть формули йонів, а не їх гідратів або сольватів:
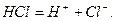
Не тільки вода, але і інші рідини, які складаються з полярних молекул, є йонізуючими розчинниками (метанол, етанол, амjyіак та інші). Тоді утворюються сольвати йонів.
Згідно з законом Кулона, сила взаємодії f між точечними зарядами е1 і е2, що знаходяться на відстані r, виражається рівнянням:

де ε - діелектрична стала середовища, в якому знаходяться заряди.
Застосовуючи закон Кулона до випадку взаємодії йонів, можна пояснити, чому хорошими розчинниками для речовин з йонним і ковалентним полярним зв’язком є тільки речовини з високою діелектричною проникненістю. Високе значення ε мають рідини, молекули яких є диполями. Серед цих рідин перше місце належить воді, діелектрична стала якої набагато вища, ніж у більшості відомих рідин. В таблиці 10 наведені значення діелектричних сталих для деяких розчинників.
Таблиця 10
Діелектричні сталі різних розчинників
| № п/п | Речовина | Діелектрична стала (ε) |
| Бензен | 2,2 | |
| Діетиловий етер | 4,3 | |
| Ацетон | 21,5 | |
| Етанол | 25,8 | |
| Метанол | 33,7 | |
| Вода | 81,0 |
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1050; Нарушение авторских прав?; Мы поможем в написании вашей работы!