
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа дисоціації
|
|
|
|
Слабкі електроліти дисоціюють тільки частково, в їх розчинах між йонами і недисоційованими молекулами (квазімолекулами для йонних кристалів), встановлюється динамічна рівновага, до якої можна застосувати закони хімічної рівноваги і записати вираз константи рівноваги. Бінарний електроліт можна записати КА. Тоді йонну рівновагу для такого електроліту можна виразити так:
 L
L 
Константа рівноваги для цього оборотного процесу називається константою дисоціації і має вигляд:

Величина К залежить від природи електроліту і розчинника, а також від температури, але не залежить від концентрації розчину. Чим більше К, тим більшою мірою електроліт дисоціює.
Багатоосновні кислоти, а також багатокислотні основи дисоціюють ступінчасто. Наприклад:
І ст.  L
L 
ІІ ст.  L
L 
Дисоціація за І ступенем характеризується константою дисоціації К1:
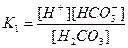 ,
,
а за ІІ ступенем – константою дисоціації К2:
 .
.
Сумарній рівновазі Н2СО3 L 2Н++СО32- відповідає сумарна константа дисоціації К:
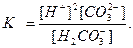
При цьому К = К1 . К2.
Аналогічні співвідношення характеризують і ступінчасту дисоціацію багатокислотних основ. Наприклад, двом ступеням дисоціації ферум(ІІ) гідроксиду:
І ст.  L
L 
ІІ ст. 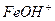 L
L 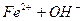
відповідають константи дисоціації:
 і
і 
Сумарній дисоціації
 L
L 
відповідає константа

При цьому К = К1.К2.
При ступінчастій дисоціації речовин
K1> K2> K3… (табл.11).
Таблиця 11
Константи дисоціації деяких слабких електролітів при 250 С
| Електроліт | Рівняння дисоціації | К |
| Нітритна кислота | 
| 4,0 . 10-4 |
| Амоній гідроксид | 
| 1,79 . 10-5 |
| Силікатна кислота | 

| 3,2 . 10-10 1,6 . 10-12 |
| Сульфітна кислота | 

| 1,3 . 10-2 6 . 10-8 |
| Сульфідна кислота | 

| 8,9 . 10-8 1,3 . 10-13 |
| Карбонатна кислота | 

| 4,31 . 10-7 5,61 . 10-11 |
| Ацетатна кислота | 
| 1,86 . 10-5 |
|
|
|
Якщо позначити молярну концентрацію електроліту, що дисоціює на два йони, через СМ, а ступінь його дисоціації через α, то концентрація кожного з йонів буде СМα, а концентрація недисоційованих молекул СМ(1-α). Тоді константа дисоціації буде мати вигляд: 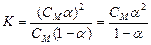 .
.
Це рівняння виражає закон розбавлення Оствальда. Для розчинів, в яких дисоціація електроліту дуже мала, рівняння Оствальда спрощується. Оскільки в таких випадках α <<1, то величиною α в знаменнику правої частини рівняння можна нехтувати. Рівняння приймає вигляд:
 або
або 
Це рівняння показує, що ступінь дисоціації слабкого електроліту зростає при розбавленні розчину.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1590; Нарушение авторских прав?; Мы поможем в написании вашей работы!