
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ступінь дисоціації. Сила електролітів
|
|
|
|
В зв’язку з тим, що ізотонічний коефіцієнт завжди виражається дробовими числами, Арреніус ввів поняття ступеня дисоціації, вважаючи, що лише частина електроліту дисоціює в розчині на йони.
Ступінь дисоціації – це відношення числа моль, що розпались на йони, до загального числа моль в розчині:
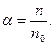
Ступінь дисоціації виражають або в частках одиниці, або у відсотках:

Пізніше було встановлено, що електроліти можна поділити на 2 групи: сильні і слабкі. Сильні електроліти в водних розчинах дисоціюють практично повністю, але в їхніх розчинах існує сильна міжйонна взаємодія, яка спричиняє зменшення електропровідності розчину і зменшення визначеного за електропровідністю ступеня дисоціації, який для сильних електролітів називають позірним.
Ту умовну концентрацію йона електроліту, відповідно до якої він поводить себе при хімічних реакціях, називають активністю і позначають а.
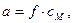
де f – коефіцієнт активності, сМ – молярна концентрація йона.
Коефіцієнт активності залежить від природи розчинника і розчиненої речовини, від концентрації розчину, а також від температури.
З розбавленням розчину f→1, а a→cM.
До сильних електролітів належать майже всі розчинні солі; кислоти Н2SO4,, HNO3,,HCl, HBr, HI, HСlO4 тощо; основи лужних і лужноземельних металів.
До слабких електролітів належить більшість органічних кислот; неорганічні кислоти H2SO3 , H2S, H2CO3,, H2SiO3, HCN; основа NH4OН і малорозчинні основи; вода.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 802; Нарушение авторских прав?; Мы поможем в написании вашей работы!