
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Погляду теорії електролітичної дисоціації
|
|
|
|
Кислоти, основи, амфотерні гідроксиди і солі з
При дисоціації будь-якої кислоти утворюються йони Гідрогену. Тому всі спільні властивості водних розчинів кислот можна пояснити присутністю гідратованих йонів Гідрогену.
Теорія електролітичної дисоціації визначає кислоти як електроліти, які дисоціюють в розчинах з утворенням йонів Гідрогену.


Оскільки спільним для всіх розчинів основ є присутність в них гідроксид-йонів, то носієм основних властивостей є гідроксид-йон. Тому з погляду теорії електролітичної дисоціації основи – це електроліти, що дисоціюють в розчинах з відщепленням гідроксид-йонів.
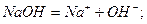

Амфотерні гідроксиди (амфоліти) мають властивості і основ, і кислот, тому взаємодіють з утворенням солей і з кислотами, і з лугами.
Явище амфотерності пояснюється тим, що в молекулах амфотерних електролітів міцність зв’язку між металом і Оксигеном мало відрізняється від міцності зв’язку між Оксигеном і Гідрогеном. Дисоціація цих молекул можлива по місцях розриву обох зв’язків:
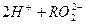 L
L  L
L 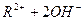 .
.
Солі – це електроліти, які дисоціюють на основні і кислотні залишки. Таких йонів, які б були спільними для всіх солей, немає. Тому солі не мають спільних властивостей. Нормальні солі дисоціюють в одну ступінь:

Кислі і основні солі дисоціюють ступінчасто:
I ст. 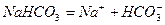
ІІ ст.  L
L 
І ст. 
ІІ ст.  L
L 
Подвійні солі, молекули яких складаються з йонів двох різних металів і кислотного залишку, дисоціюють в одну ступінь:


|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 608; Нарушение авторских прав?; Мы поможем в написании вашей работы!