
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обчислення рН для одноосновних кислот і однокислотних основ
|
|
|
|
1. Сильні одноосновні кислоти, дисоціюють на йони повністю, наприклад HCl:
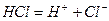
тому СМ(Н+) = СМ(HCl) і рН = -lgСМ кислоти.
2. Сильні однокислотні основи (луги), також дисоціюють на йони повністю, наприклад,  :
:
 L
L 
тому СМ(ОН-) = СМ(NaOH) і рОН = -lg СМ лугу, а рН = 14-рОН.
3. Для слабких одноосновних кислот процес дисоціації є оборотним, наприклад:
 L
L 
де СМ(Н+) СМ(СН3СООН), а СМ(СН3СОО-) = СМ(Н+).
Константа дисоціації для ацетатної кислоти дорівнює:
 ,
,
або 
якщо підставити в вираз замість СМ(СН3СОО-) рівну їй СМ(Н+).
Якщо α - ступінь дисоціації, то Н+ = СМ(СН3СОО-) = СМα, а молярна концентрація недисоційованої ацетатної кислоти дорівнює:
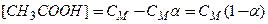 .
.
Підставимо це значення в вираз константи дисоціації і одержимо: 
Якщо 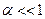 , то
, то 
звідки  .
.
Тоді 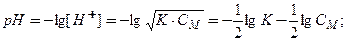
Замінимо 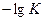 на
на 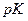 , тоді
, тоді
 .
.
4. Для однокислотної основи, наприклад NH2OH, процес дисоціації також оборотний:
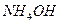 L
L 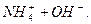
Виконавши аналогічні розрахунки, одержимо:

 .
.
(див.таблицю 11).
Для вимірювання рН існують різні методи. Наближено можна визначити рН за допомогою спеціальних реактивів-індикаторів. Індикатори – це слабкі органічні кислоти або основи, які мають різне забарвлення недисоційованих молекул і йонів. Наприклад,
 L
L 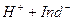 (а)
(а)
 L
L 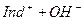 (б)
(б)
За принципом Ле Шательє в кислому середовищі в системі (а) рівновага зсувається вліво, в лужному – вправо, в системі (б) – нав-паки. В результаті зсуву рівноваги відбувається зміна забарвлення. Найбільш поширені індикатори – метиловий оранжевий, фенол-фталеїн, лакмус та ін. Лакмус і фенолфталеїн належать до слабких органічних кислот, а метиловий оранжевий – до слабких основ.
Таблиця 12
Область переходу та характерне забарвлення індикаторів
| Індикатор | Інтервал переходу рН | Зміна забарвлення |
| Метиловий оранжевий | 3,1 – 4,4 | Червоний – оранжевий – жовтий |
| Лакмус | 5,0 – 8,0 | Червоний –фіолетовий – синій |
| Фенолфталеїн | 8,2 – 10,0 | Безбарвний – блідо малиновий - малиновий |
Метиловий оранжевий при рН 3,1 червоний, при рН 4,4 – жовтий, а в інтервалі рН 3,1 – 4,4 змінює забарвлення від червоного до жовтого. Цей проміжок називається областю переходу або інтервалом індикатора. Лакмус змінює забарвлення від червоного до синього в інтервалі рН 5,0 – 8,0; а фенолфталеїн від безбарвного до малинового в інтервалі 8,2 – 10,0. Найбільш універсальний – лакмус. Цим індикатором можна визначити і кисле, і лужне, і нейтральне середовище.
З точністю до одиниці можна визначити рН за допомогою універсального індикатора (суміш індикаторів), а з точністю до 0,01 – приладом рН –метром.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 504; Нарушение авторских прав?; Мы поможем в написании вашей работы!