
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гідроліз солей
|
|
|
|
Дослід показує, що реакція середовища в водних розчинах залежить не тільки від наявності в них кислот або лугів, але також і від присутності солей. Деякі солі, розчиняючись у воді, можуть змінювати реакцію середовища. При цьому відбувається хімічна взаємодія між йонами солі і йонами Н+ і ОН- води, яка супроводжується утворенням слабких електролітів, що призводить до зміни рН середовища. Цей оборотний процес називається гідролізом.
Солі, утворені сильною кислотою і сильною основою, не гідролізуються і не змінюють рН розчину, тому що їх йони – залишки сильних електролітів – не можуть утворювати з йонами води недисоційовані сполуки.
Гідролізуються солі, утворені сильною основою і слабкою кислотою (Na2CO3, KNO2), слабкою основою і сильною кислотою (NH4Cl) або слабкою основою і слабкою кислотою (NH4NO2).Солі, утворені слабкими основами і дуже слабкими леткими кислотами, гідролізуються необоротно.
Рівняння реакцій гідролізу записують в молекулярному і йонному вигляді:
 L
L 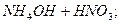
молекулярне рівняння
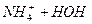 L
L 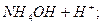
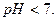
скорочене йонно-молекулярне рівняння
У воді концентрації йонів Н+ та ОН- однакові. При розчиненні в ній амоній нітрату катіони слабкої основи NH4+ зв’язуються з йонами ОН- і утворюють слабкий електроліт NН4ОН. Концентрація йонів Н+ в розчині збільшується, середовище стає кислим, рН <7.
Солі, утворені слабкою основою і сильною кислотою, в воді гідролізуються за катіоном, мають кислу реакцію розчину і належать до гідролітично кислих.
Амоній нітрат (аміачна селітра) в меліорації використовують як азотне добриво для рослин, які вирощують на лужних грунтах (солонці, солончаки) і які потребують підкислення середовища. З цією ж метою використовують амоній сульфат (NH4)2SO4. Застосовувати аміачні солі як добрива на кислих грунтах необхідно обережно, тому що підкислення кислого грунту може зменшити врожай. Поряд з аміачними добривами на підзолистих грунтах та інших кислих грунтах вносять вапно, яке підвищує рН грунтового розчину.
Солі, утворені слабкою кислотою і сильною основою, наприклад, калій нітрит, зв’язують з води йони Гідрогену (гідроліз за аніоном). Йони ОН- накопичуються, і розчин стає лужним:
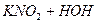 L
L 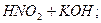
 L
L 

середовище лужне
Такі солі – гідролітично лужні.
Якщо сіль утворена слабкою основою та слабкою кислотою, гідроліз відбувається як за катіоном, так і за аніоном, зв’язуються обидва йони води. Внаслідок цього рН розчину мало змінюється, визначається значеннями констант дисоціації слабких електролітів, які утворюються внаслідок гідролізу:


 L
L 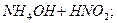
 L
L 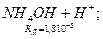
 L
L 
Середовище слабкокисле внаслідок того, що НNO2 більш сильний електроліт.
Здатність солі гідролізуватись характеризується константою гідролізу (КГ). КГ залежить від йонного добутку води (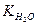 ) та констант дисоціації слабких електролітів, які утворюються при гідролізі. Для трьох видів солей, які підлягають гідролізу і утворені: а) слабкою основою; б) слабкою кислотою; в) слабкою основою і слабкою кислотою, КГ буде дорівнювати:
) та констант дисоціації слабких електролітів, які утворюються при гідролізі. Для трьох видів солей, які підлягають гідролізу і утворені: а) слабкою основою; б) слабкою кислотою; в) слабкою основою і слабкою кислотою, КГ буде дорівнювати:
а) 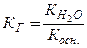 ; б)
; б) 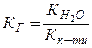 ; в)
; в) 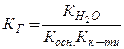 .
.
Наприклад, для NH4NO3 КГ дорівнює:
 .
.
Рівновага процесу гідролізу завжди зміщена вліво, тобто в напрямку утворення найбільш слабкого електроліту – води (КД(Н2О) = 1,8 х 10-16).
Процес гідролізу характеризується ступенем гідролізу h. Це відношення молярної концентрації гідролізованої солі (СМ гідр.) до вихідної молярної концентрації розчиненої солі (СМ вих.):
 або
або 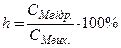 .
.
Ступінь гідролізу можна визначити з КГ та молярної концентрації розчину солі. Наприклад, ступінь гідролізу амоній нітрату в 0,1М розчині при 250 С дорівнює:
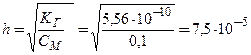
або 7,5 . 10-5 . 100%.
Для дуже розбавлених розчинів, наприклад, для 0,001М концентрацій, використовують більш точні формули. За ступенем гідролізу розраховують концентрації Н+ та ОН- - йонів та рН розчинів:
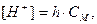

Відмічається значна зміна рН розчинів навіть при невисоких значеннях ступенів гідролізу солей. Саме тому накопичення соди в солонцевих грунтах значно підвищує лужність середовища та знижує родючість грунту.
Ступінь гідролізу солі збільшується з підвищенням температури та розбавленням розчину. При 250 С ступінь гідролізу Na2CO3 в 0,1М розчині дорівнює 4,62%, а в 0,001М – 36,7%. З метою змен-шення ступеня гідролізу розчини треба зберігати концентрованими, при низьких температурах.
Гідроліз солей, утворених слабкими багатоосновними кислотами (Na2CO3, Na2S, Na3PO4) або слабкими багатокислотними основами (CuCl2, Mg(NO3)2, AlCl3), відбувається ступінчасто, але практично проходить за першим ступенем.
1 ст. 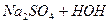 L
L 
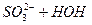 L
L 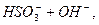 середовище лужне
середовище лужне 
додавання Н+
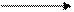
Внаслідок гідролізу солей слабких багатоосновних кислот за 1-им ступенем утворюється кисла сіль. Середовище лужне. Для посилення гідролізу слід додати кислоту, тобто йони Н+. Тоді за принципом Ле Шательє рівновага зміститься вправо. Зменшиться концентрація ОН- - йонів внаслідок з’єднання їх з добавленними йонами Н+. Гідроліз відбудеться за ІІ-им ступенем, і утвориться слабка кислота:
ІІ ст. 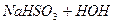 L
L 
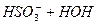 L
L 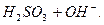
Гідроліз солі, утвореної слабкою двокислотною основою, відбувається в два ступені.
За першим ступенем утворюється основна сіль. Якщо додати лугу, рівновага реакції зміститься вправо, і закінчиться гідроліз утворенням гідроксиду:
І ст.  L
L 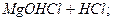
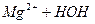 L
L 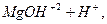 середовище кисле
середовище кисле 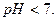
додавання ОН+
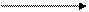
ІІ ст. 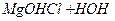 L
L 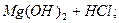
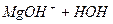 L
L 
Реакція гідролізу MgCl2 використовується в будівництві – утворення магнезіального цементу. Кисле середовище захищає від загнивання тирсу, яку додають як наповнювач при одержанні магнезіально-цементного каменю-ксилоліту. Він використовується для виготовлення плит, підвіконників, підлог тощо.
Якщо сіль утворена дуже слабкою основою і дуже слабкою леткою кислотою, то гідроліз проходить до кінця:
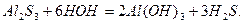
Якщо в воду додати дві солі, одна з яких утворена сильною основою і слабкою кислотою (Na2CO3), а друга, навпаки, слабкою основою і сильною кислотою (СuCl2), то відбувається спільний гідроліз солей.
Одна сіль посилює гідроліз другої, і гідроліз кожної солі проходить до кінця:
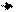
 L
L 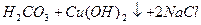
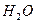
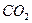
 L
L 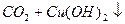
Реакції спільного гідролізу використовують з метою очистки каламутної природної води.
Природнa вода завжди містить деяку кількість Са(НСО3)2 та Mg(HCO3)2. Додавання солей Алюмінію або Феруму(ІІІ) призводить до спільного гідролізу, який закінчується утворенням відповідних гідроксидів:
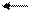

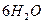
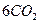
Завдяки великій активній поверхні гідроксиди Al(ОН)3 або Fe(OH)3 у вигляді колоїдних частинок можуть поглинати з води колоїдні домішки та знебарвлювати її.
Процес гідролізу відбувається при утворенні цементного каменю в бетонних сумішах. Додавання деяких солей при замішуванні цементу (бетону) змінює властивості одержаного каменю. Солі тривалентних металів (Al, Fe) завдяки ступінчастому гідролізу в лужному (рН >7) бетонному розчині утворюють колоїдні гідроксиди, які заповнюють пори і підвищують міцність бетонного каменю. Нітрити лужних та лужноземельних металів KNO2, Ca(NO2)2, підвищують в бетоні тривкість металевих конструкцій до корозії, створюючи в результаті гідролізу лужне середовище.
Процеси грунтоутворення зв’язані з вивітрюванням материнських гірських порід, їх гідратацією та гідролізом. Йони Аl3+ в грунтовому розчині з’являються внаслідок руйнування алюмосилікатів і при взаємодії з водою знижують рН ґрунтового розчину:
 L
L 
Грунтова кислотність, яка спричиняється наявністю йонів Н+ та Al3+, погано впливає на розвиток рослин. В присутності йонів Аl3+ при низьких значеннях рН йони Са2+ майже не поглинаються грунтом.
Отже, гідроліз відіграє велику роль в технологічних процесах, в ґрунтоутворенні, в живих організмах.
Завдання для самоконтролю
1. Які речовини називають електролітами?
2. Які сполуки належать до електролітів?
3. Який процес називається електролітичною дисоціацією?
4. Які основні положення теорії електролітичної дисоціації?
5. На які дві групи поділяють електроліти?
6. Чим відрізняються сильні електроліти від слабких?
7. Яка специфіка перебігу реакцій в розчинах електролітів?
8. В якому випадку реакції в розчинах електролітів відбуваються до кінця?
9. До яких електролітів – сильних чи слабких належить вода?
10. Яка концентрація йонів Н+ та ОН- в нейтральному, кислому та лужному середовищах?
11. Вміст яких йонів в розчині характеризує водневий показник? Як він позначається?
12. Які має значення водневий показник в нейтральному, кислому та лужному середовищах?
13. В чому полягає сутність процесу гідролізу?
14. Якого складу солі підлягають гідролізу?
15. Як відбувається гідроліз солей, утворених: а) багато-основними кислотами; б) багатокислотними основами?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3019; Нарушение авторских прав?; Мы поможем в написании вашей работы!