
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дисоціація води. Йонний добуток води. Водневий показник
|
|
|
|
Вода є середовищем, в якому відбуваються різноманітні хімічні процеси. Вона є полярним розчинником і сприяє дисоціації багатьох розчинних в ній речовин. Хімічно чиста вода є слабким електролітом і подібно до кислот, основ і солей частково дисоціює на йони:
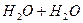 L
L 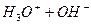 або
або 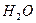 L
L 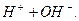
Старанно очищена вода має незначну електропровідність. Константа електролітичної дисоціації води, яка за законом діючих мас виражається рівнянням:
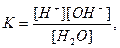
при 250 С дорівнює 1,8 . 10-16, а ступінь дисоціації води - 1,7.10-9. Враховуючи незначний ступінь дисоціації води (з 555 млн молекул тільки одна дисоціює на йони), концентрацію недисоційованих молекул можна вважати сталою: [H2O] = const.
Тоді, рівняння можна представити:
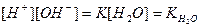 ,
,
де 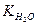 - йонний добуток води. Оскільки в 1л води знаходиться 1000 г: 18 г/моль = 55,56 моль Н2О, то, підставивши це значення, а також чисельне значення константи дисоціації води в рівняння, одержимо:
- йонний добуток води. Оскільки в 1л води знаходиться 1000 г: 18 г/моль = 55,56 моль Н2О, то, підставивши це значення, а також чисельне значення константи дисоціації води в рівняння, одержимо:
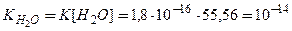 (при 250С)
(при 250С)
Отже, в будь-якому водному розчині при сталій температурі добуток концентрацій йонів Гідрогену і гідроксид-йонів є величиною сталою:
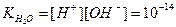 (моль/л)2
(моль/л)2
Дослід показує, що дисоціація води – ендотермічний процес, тому у відповідності з принципом Ле Шательє при підвищенні температури рівновага зсувається в бік утворення йонів, і йонний добуток води збільшується. Наприклад, при температурі 600 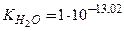 .
.
Якщо 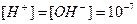 моль/л – середовище нейтральне
моль/л – середовище нейтральне
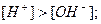
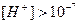 моль/л – середовище кисле
моль/л – середовище кисле
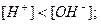
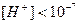 моль/л – середовище лужне
моль/л – середовище лужне
Ступінь кислотності або лужності виражають водневим показником рН і гідроксидним показником – рОН.
Водневим показником рН називають десятковий логарифм концентрації йонів Гідрогену, взятий з оберненим знаком:

Гідроксидним показником рОН називають десятковий логарифм концентрації гідроксид-йонів, взятий з оберненим знаком:
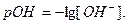
Поняття „водневий показник” було введене датським хіміком Серенсеном в 1909 р. Буква „ р ” – перша буква датського слова potenz – математичний ступінь, буква Н – символ Гідрогену.
Для абсолютно чистої води при 250С рН = - lg10-7 = 7. В кислих розчинах рН < 7, в лужних рН > 7.
Прологарифмувавши рівняння йонного добутку води, помінявши знаки на протилежні і замінивши 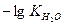 на
на 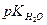 , одержимо:
, одержимо:
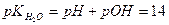 .
.
Кожний йон відіграє особливу роль в різних біологічних процесах, однак водневі йони займають особливе положення серед інших. Концентрація водневих йонів є однією з найважливіших констант внутрішнього середовища організму. Так, рН крові людини дорівнює 7,36. Найменше відхилення від цього значення веде до серйозних порушень життєдіяльності.
Концентрація водневих йонів має велике значення в життєдіяльності різних мікроорганізмів. Наприклад, бактеріальний процес засвоєння атмосферного азоту бактеріями на коренях бобових рослин відбувається при певному значенні рН грунту, приблизно 7,2; дифтерійний мікроб розвивається при рН в межах 7,3-7,6, а кишковий мікроб – при рН 6-7.
Використання рослинами різних поживних елементів з грунту також значною мірою залежить від рН середовища. Так, дослідженнями Д.М.Прянишнікова було встановлено, що нітратний Нітроген (NO3-) краще засвоюється рослинами в слабкокислому середовищі при рН приблизно 5, а Нітроген амонійний NH4+ краще засвоюється в нейтральному середовищі при рН 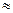 7. Відношення вищих рослин до рН грунту також різне. Для кожної рослини встановлена найбільш оптимальна реакція середовища.
7. Відношення вищих рослин до рН грунту також різне. Для кожної рослини встановлена найбільш оптимальна реакція середовища.
Наприклад, для картоплі –5, для жита – 5-6, для пшениці – 6-7, гороху – 6-7, буряка – 7, кукурудзи – 7 і т.ін.
Нейтральну реакцію з невеликими відхиленнями мають чорноземи; підзолисті, дерново-підзолисті та болотяні грунти мають, як правило, кисле середовище; засолені грунти – лужне середовище. Надлишкову кислотність усувають вапном Са(ОН)2, а надлишкову лужність – гіпсом СaSO4 . 2Н2О.
Не менш важливе значення має реакція середовища і в області технічної біохімії і хімічної технології. Наприклад, контроль технологічного процесу і якості готової продукції за величиною рН має велике значення в харчовій, м’ясній, молочній промисловості. Під впливом рН можуть змінюватись розчинність, поверхневий натяг, осмотичний тиск і інші властивості. Ось чому визначення рН знайшло застосування в хімії, біології, агрохімії, медицині і в інших галузях науки і практики.
Число вільних гідратованих йонів Гідрогену визначає так звану активну кислотність, а число вільних гідроксид-йонів – активну лужність.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3062; Нарушение авторских прав?; Мы поможем в написании вашей работы!