
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторний практикум для виконання індивідуальних навчально-дослідних завдань
|
|
|
|
Практичні завдання.
Теоретичні питання.
План лабораторних занять
К.пед.н. Бабенко О.М.
Спеціалізація Інформатика
факультет природничо-географічний
укладач:
| № заняття | Тема заняття та вид навчальної діяльності | Кількість балів |
| 1. | Опрацювання теоретичних питань і практичних завдань теми «Предмет вивчення і завдання хімії довкілля» | |
| 2. | Опрацювання теоретичних питань і практичних завдань теми «Хімія атмосфери» | |
| 3. | Лабораторний практикум «Хімія атмосфери» Розв’язок задач | |
| 4. | Опрацювання теоретичних питань і практичних завдань теми «Хімія гідросфери» | |
| 5. | Лабораторний практикум «Хімія гідросфери» | |
| 6. | Опрацювання теоретичних питань і практичних завдань теми «Хімія літосфери» | |
| 7. | Лабораторний практикум «Хімія літосфери» | |
| 8. | Розв’язок задач | |
| 9. | Опрацювання теоретичних питань і практичних завдань теми «Вплив забруднення довкілля на організм людини» | |
| 10. | Лабораторний практикум «Вплив забруднення довкілля на організм людини» | |
| 11. | Захист ІНДЗ | |
| Тестовий контроль – 25 запитань протягом 25 хв. | ||
| Разом |
Тема: Предмет вивчення і завдання хімії довкілля
Мета: Розглянути склад і особливості будови основних об'єктів вивчення хімії довкілля: гідросфери, атмосфери, біосфери та літосфери.
1. Історія виникнення та розвитку науки "Хімія довкілля", її завдання.
2. Теорії виникнення хімічних елементів і Всесвіту:
ž виникнення хімічних елементів;
ž виникнення Всесвіту;
ž утворення зірок;
ž виникнення Сонячної системи;
ž виникнення й історія Землі;
ž поява життя й етапи еволюції біосфери.
|
|
|
3. Хімічний склад і будова планети Земля та її основних сфер.
4. Опис біогеохімічних циклів речовин. Вивчення антропогенної дії на природні біогеохімічні цикли.
1. Опрацювавши запропоновану літературу, встановити зміст основних понять дисципліни "Хімія довкілля" і показати їх взаємозв’язок у вигляді схеми.
2. Порівняти різні теорії виникнення та влаштування Всесвіту.
3. Біогеохімічні цикли елементів і речовин (Карбон, Оксиген, Нітроген, Фосфор, вода) і їх кількісні характеристики.
4. Підготуватися до розв’язування задач хіміко-екологічного змісту.
5. Підготувати відеоматеріал, що ілюструє основні теорії походження Всесвіту. Тривалість відео роликів не довше 10 хв.
З «ХІМІЇ ДОВКІЛЛЯ»
ПРАКТИЧНА РОБОТА «Визначення сульфат-іонів у природній воді»
Сульфатні йони, SO42‾, широко розповсюджені. Вони поступаються, Так йонам Хлору у високо мінералізованих водах, але переважають над ним в більшості мало і помірно мінералізованих вод. Вміст сульфат-іонів, на відміну від хлорид-іонів них лімітується присутністю йонів Кальцію. Сульфат-іони утворюють з Са2+ порівняно малорозчинний CaSO4. Добуток розчинності CaSO4 дорівнює [Са2+] ∙ [SO42‾] = 6,1∙10‾5. У присутності сторонніх солей розчинність CaSO4 значно підвищується. У морській воді, наприклад, це позначається на збільшенні вмісту SO42‾ до 2,7 г/кг при вмісті Са2+ близько 0,208 г/кг. При малому вмісті йонів Кальцію концентрація сульфат-іонів може досягати великих величин.
Сульфат-іони біологічно нестійкі і, за відсутності кисню (анаеробні умови), можуть бути відновлені до сірководню. Такого роду процес, званий сульфаторедукцією, протікає, наприклад, в глибинах деяких морів і в водах нафтоносних родовищ. Він відбувається під дією бактерії (Microspira) у присутності органічної речовини і може бути виражений такою приблизною схемою:
2SO42‾ + 4С + 3Н2О → H2S + HS‾ + СО2 + 3НСО3‾.
|
|
|
Присутність сульфатредукуючих бактерій виявлено у водах нафтоносних родовищ на глибинах до 2000 м. Сірководень, що утворюється, при зіткненні з повітрям знову окинюється до сірки:
2H2S + О2 = 2Н2О + 2S ↓, а потім до SO42‾.
Визначення засноване на осадженні сульфатів у кислому середовищі барій хлоридом у вигляді барій сульфату. Осад відфільтровують, прожарюють і зважують. Метод можна застосовувати в широкому діапазоні концентрацій. Каламутні води попередньо відфільтровують.
Прилади та обладнання: піпетка, дозатор.
Реактиви: 10%-ний і 5%-ний розчини барій хлориду; хлоридна кислота (густина 1,19 г/см3) і розведений (1: 5) розчин; 10%-ний розчин аргентум нітрату (розчиняють 10 г AgNO3 в 100 мл дистильованої води, підкисляють 0,5 мл нітратної кислоти з густиною 1,42 г / см3; метиловий оранжевий; стандартні розчини калій сульфату: розчин а) основний розчин: у мірній колбі місткістю 1 л розчиняють 0,9071 г безводного K2SO4 і доводять об'єм до мітки (у 1 мл міститься 0,5 мг сульфатів); розчин б) робочий розчин отримують разведенням основного в 10 разів (у 1 мл міститься 0,05 мг сульфатів).
Приблизний вміст сульфат-іонів може бути визначений візуально за кількістю осаду барій сульфату, що випадає при доливанні в пробірку з 5 мл проби води 3 крапель 10% розчину барій хлориду.
| Вигляд реакційної суміші | Концентрація SO42-, мг/л |
| Відсутність помутніння | менше 5 |
| Слабке помутніння, що з’являється через декілька хвилин | 5-10 |
| Слабке помутніння, що з’являється відразу | 10-100 |
| Сильне помутніння, що швидко осідає | 100-500 |
Якісна проба з наближеною кількісною оцінкою. У колориметричну пробірку вносять 10 мл досліджуваної води, додають 0,5 мл хлоридної кислоти (1: 5). Готують шкалу стандартних розчинів: вносять в перші пробірки 2-4-8 мл робочого стандартного розчину калій сульфату і в наступні 1,6-3,2-6,4 мл основного розчину, об'єм у всіх пробірках доводять дистильованою водою до 10 мл. Виходить шкала розчинів з вмістом 10-20-40-80-160- 320 мг/л сульфатів. У всі пробірки додають по 0,5 мл хлоридної кислоти (1: 5). Потім в пробірки з досліджуваною водою і стандартними розчинами вносять по 2 мл 5% барій хлориду, перемішують. Порівнюють досліджувану воду зі шкалою стандартних розчинів.
Кількісне визначення. Об'єм води для проведення аналізу залежить від передбачуваного вмісту сульфатів:
|
|
|
при вмісті сульфат-іонів менше 50 мг/л беруть 500 мл води,
50-100 мг/л – 250 мл,
200- 500 мг/л – 100 мл,
більше 500 мг/л – 50 мл.
Відміряний об'єм досліджуваної води поміщають у стакан, додають 2-3 краплі індикатора метилового оранжевого і хлоридну кислоту до рожевого забарвлення розчину. Суміш нагрівають до кипіння і випарюють до 50 мл, дають відстоятися і при наявності каламуті або пластівців фільтрують через беззольний фільтр «синя стрічка». Фільтр промивають дистильованою водою, подкисленою хлоридною кислотою, фільтрат разом з промивними водами знову випарюють в стаканчику до 50 мл.
У киплячий розчин при помішуванні вносять 10 мл 5% гарячого барій хлориду, розчин з осадом нагрівають на водяній або піщаній бані при 80-90 ° С. Коли розчин освітлиться, перевіряють повноту осадження, додаючи 1-2 краплі 5% барій хлориду. Відсутність каламуті свідчить про повне осадження сульфатів. Стакан накривають годинниковим склом і нагрівають 1-2 год. на водяній або піщаній бані, після чого залишають при кімнатній температурі до наступного дня. Потім розчин фільтрують через щільний беззольний фільтр «синя стрічка», який необхідно попередньо промити гарячою дистильованою водою, а для ущільнення – етанолом. Осад барій сульфату декільки разів декантують дистильованою водою, фільтруючи воду через фільтр, потім кількісно на цей же фільтр переносять осад скляною паличкою з гумовим наконечником. Осад на фільтрі промивають кілька раз гарячою дистильованою водою до негативної реакції на хлорид-іон (до проби фільтрату в пробірці додають кілька крапель аргентум нітрату). Фільтр з осадом поміщають у попередньо прожарений зважений тигель, просушують, обвуглюють, не допускаючи займання, потім прожарюють в муфельній печі при температурі не вище 800 ° С до отримання осаду білого кольору. Охолоджують в ексикаторі, зважують, знову прожарюють до постійної маси.
Концентрацію сульфатів (мг/л) розраховують за формулою:
 , де
, де
А, В – маса тигля з осадом і порожнього тигля відповідно, мг;
|
|
|
0,4115 – коефіцієнт для перерахунку барій сульфату на сульфат-іон;
V – об'єм проби, взятої для визначення, мл.
ПРАКТИЧНА РОБОТА «Визначення розчиненого у воді кисню»
Вміст кисню у воді має велике значення при оцінці якості поверхневих вод, деяких стічних вод, при оцінці і контролі роботи станцій біологічної очистки та ін. Вміст кисню у воді коливається від 6 до 10 мг/л, рідко перевищуючи 15 мг/л. Визначення розчиненого у воді кисню проводиться йодометричним методом Вінклера, який заснований на здатності манган(ІІ) гідроксиду окиснюватися в лужному середовищі до сполук з вищим ступенем окиснення, кількісно зв'язуючи розчинений у воді кисень. Процес зв'язування кисню виражається рівняннями:
4MnCl2 + 8NaOH = 8NaCl + 4Mn(OH)2
2Mn(OH)2 + O2 = 2H2MnO3
2H2MnO3 + 2Mn(OH)2 = 2Mn2O3 + 4H2O
Режим розчиненого кисню сильно впливає на життя водного об'єкта. Мінімальна концентрація розчиненого кисню, необхідна для нормального розвитку риби, становить близько 5 мг/л. Зниження її до 2 мг/л викликає їх масову загибель. Несприятливе і пересичення води киснем. ГДК кисню – не менше 4 мг/л.
Приготування реактивів.
1. Реактиви Вінклера. Розчиняють 210 г манган(ІІ) хлориду тетрагідрату в дистильованій воді та доводять об'єм до 500 мл. Якщо розчин каламутний, його слід профільтрувати. Можна використати 200 г манган(ІІ) сульфату тетрагідрату. Лужний розчин калій йодиду (KI + NaOH) готують так: 75г KI розчиняють в 50 мл дистильованої води, а потім змішують з розчином, що складається з 250г NaOH і 150-200мл дистильованої води, після чого загальний об’єм доводиться водою до 500 мл. При відсутності NaOH можна застосовувати 350 KOH, а замість KI можна застосовувати 68 г NaI.
2. Сульфатна кислота (1:1) або концентрована ортофосфатна кислота (85%).
3. 0,2% розчин крохмалю (свіжоприготований).
4. Натрій тіосульфат пентагідрат Na2S2O3∙5H2O, 0,01н (або 0,002н).
5. Калій дихромат K2Cr2O7, 0,01н для установки титру натрій тіосульфату.
Виконання аналізу. У пікнометри за допомогою сифона (або у склянки з притертими пробками а допомогою піпеток) наливають досліджувану воду. Не закриваючи пікнометр пробкою, додають реактиви Вінклера – по 1 мл кожного. Піпетку з реактивом опускають на одну третину склянки. Спочатку додають лужний розчин калій йодиду, потім Манган хлориду. Закривають пробкою так, щоб не було бульбашок повітря, і перемішують. Пробу ставлять у темне місце на 1-2 години або на добу. Після відстоювання відкривають пробку і додають 1 мл концентрованої ортофосфорної або розбавленої (1:1) сульфатної кислоти. Закривають пробкою. Перемішують до розчинення осаду і титрують натрій тіосульфатом (0,01 н.) до блідо жовтого кольору. Додають 0,5 мл крохмалю і тирують до повного знебарвлення. Обмивають відтитрованим розчином стінки склянки і дотитровують.
Розрахунки ведуть за формулою:
 , мл О2 у 1 л; де
, мл О2 у 1 л; де
n – об’єм натрій тіосульфату, який пішов на титрування, мл;
F – поправка;
V – об'єм досліджуваної води;
v – об'єм доданих реактивів Вінклера.
Визначення поправки: до 1 мл 15% KI додають 3 мл 25% розчину сульфатної кислоти і 20 мл 0,01 н. розчину калій дихромату. Ставлять на три хвилини в темряву, накривши годинниковим склом. Титрують розчином натрій тіосульфату. Обчислюють поправку:
 , де
, де
В – число мл натрій тіосульфату, який пішов на титрування.
ПРАКТИЧНА РОБОТА «Визначення кислотності ґрунту»
Проникаючи в ґрунт, атмосферна вода, що містить у своєму складі в незначних кількостях вуглекислий газ, амоніак, нітритну й нітратну кислоти і т.п., перетворюється в ґрунтовий розчин. Ґрунтовий розчин бере безпосередню участь у біохімічних і фізико-хімічних реакціях ґрунту, в обміні і кругообігу різних речовин, а також у живленні рослин. За своїм хімічним складом ґрунтові розчини досить різні: в них можуть бути виявлені різні неорганічні сполуки – нітрати, нітрити, сульфати, сульфіди, карбонати, гідрогенкарбонати, хлориди, фосфати, а також сполуки Алюмінію, Мангану, Феруму і т.п. Крім неорганічних сполук, в ґрунтовому розчині зустрічаються: кренова кислота і її солі, цукру, розчинні білкові сполуки, амінокислоти і т.п.
Концентрація розчинів солей залежить від кліматичних умов і від пори року. Залежно від вмісту солей і кислот ґрунтовий розчин по своїй хімічній реакції може бути або нейтральним, або лужним, або кислотним. Нейтральний розчин характеризується наявністю в ґрунті лугів, що нейтралізують ґрунтову кислоту. Надлишки вапна викликають лужну реакцію, навпаки, нестача веде до підвищення кислотності ґрунту. У ґрунтознавстві прийнято визначати три види кислотності: активну, обмінну і гідролітичну.
У ґрунті можуть перебувати у вільному стані як органічні, так і неорганічні кислоти. Від їх присутності і залежить наявність активної кислотності. Збільшення ступеня кислотності ґрунту залежить також від вмісту СО2 в ґрунтовому повітрі, навпаки, зменшенню кислотності сприяє наявність у ґрунті карбонатів.
Кислотність ґрунтових розчинів виражають величиною рН. При аналізі ґрунту залежно від величини рН встановлюють ступінь кислотності. Найбільшою кислотністю володіють ґрунти, що мають рН = 3, зі збільшенням рН падає кислотність, а при рН = 7 ґрунт має нейтральну реакцію. Далі лужність наростає в межі від рН = 8 до рН = 14. При дуже кислій реакції ґрунту (рН = 4) можна припускати наявність в ній сильних мінеральних кислот. При визначенні кислотності або лужності вдаються до титрування в присутності індикаторів. Витяжки кислих ґрунтів титрують лугами, лужних – кислотами. При аналізі з'ясовується кількість кислоти або лугу, що містяться в певному об’ємі ґрунтового розчину, що титрується.
Так як при активній кислотності в ґрунті містяться сильні кислоти, титрування проводять сильним лугом у присутності індикаторів (фенолфталеїну, метилового оранжевого або лакмусу).
При обмінної кислотності йони Гідрогену знаходяться в прихованому стані. Для виявлення обмінної кислотності ґрунту необхідно йони Гідрогену витіснити зі сполуки за допомогою будь-яких нейтральних солей, наприклад: KCl, NaCl, BaCl2 та ін. Найчастіше з цією метою застосовують 1 н розчин KCl або 1 н розчин BaCl2. Відбувається наступна реакція:
ґрунт Н + KCl = HCl + ґрунт K.
Хлоридну кислоту, що утворюється, титрують сильною лугом у присутності фенолфталеїну або метилового оранжевого. На думку деяких авторів, обмінну кислотність дають тільки гумінові кислоти.
Гідролітична кислотність визначається кількістю йонів Гідрогену, які витискуються з ґрунту водним розчином солі слабкої кислоти і сильної основи, наприклад натрій ацетатом або кальцій ацетатом, які володіють лужною реакцією. Процес протікає таким чином: натрій ацетат або кальцій ацетат дисоціюють у водному розчині:
CH3COONa + H2O = CH3COOH + NaOH
Як відомо, етанова кислота є слабкою кислотою і практично не дисоціює, в той час як натрій гідроксид, будучи сильною лугом, повністю дисоціює в ґрунтовому розчині. Луг, перебуваючи в дисоційованому стані, зустрічається в ґрунтовому розчині з колоїдними речовинами, поверхневі частки яких заряджені негативно (ацидоїди) і обмінними йонами Гідрогену, Кальцію, Магнію, Калію та ін. На відміну від ацидоїдів існують базоїди, поверхневі частки яких заряджені позитивно, і обмінними іонами у них є аніони. Позитивно заряджений йон Натрію стає на місце Гідрогену, а останній сполучаэться з йоном гідроксиду, при цьому утворюється молекула води. Кількість етанової кислоти, що утворилася в результаті дисоціації її солі, показує, скільки вступило в реакцію йонів натрію. Таким чином, провівши титрування етановою кислотою, можна виявити, скільки обмінних іонів Гідрогену знаходилося в ґрунтовому розчині, і тим самим визначити кислотність.
CH3COONa → CH3COO‾ + Na+
RCOOH + Na+ = RCOONa + H+
CH3COO‾ + H+ = CH3COOH
Титрування етанової кислоти ведуть 0,1 н розчином натрій гідроксиду в присутності індикатора фенолфталеїну.
При аналізі ґрунту виявляється спочатку активна і обмінна кислотність, а потім гідролітична. Активна і обмінна кислотність визначається сумарно за допомогою титрування сольової витяжки ґрунту. Визначивши всі три види кислотності, з'ясовують, чи потрібно проводити вапнування. Не всякий ґрунт вимагає вапнування. Прийнято вважати, що слід обов'язково вапнувати тільки в тому випадку, якщо рН менше 4,5. Менше потребують вапнування ґрунти, рН яких лежить між 4,5-5,5, і, нарешті, ґрунту, які не потребують вапнування, мають рН більше 5,5.
Визначення активної кислотності. Кількість кислоти, що знаходиться в ґрунті, визначається шляхом титрування або визначення рН за допомогою індикаторів.
Матеріали та реактиви: піпетка на 10 мл; чашки порцелянові; мензурка з поділками в 1 мл; ложка або шпатель порцелянові; стаканчики на 50 і 100 мл; ваги технохімічні з наважками; універсальний індикатор.
Хід визначення. Для проведення аналізу беруть з різних місць ділянки ґрунт, просушують його, потім відважують дві порції по 20 г кожна. Помістивши кожну порцію ґрунту в окремі стаканчики ємністю 100 мл, наливають 40 мл дистильованої води і добре перемішують, після чого рідині дають відстоятися до повного просвітлення. Якщо після довгого стояння розчин залишається каламутним, його фільтрують, але першу порцію фільтрату виливають, так як фільтрувальний папір завжди містить луг. Відстояну рідину обережно зливають в невелику колбу, з неї відливають в чисту пробірку 3 мл ґрунтового розчину і визначають значення рН за допомогою універсального індикатора.
Визначення обмінної кислотності.
Якщо ґрунт має кислотність рН менше 5, то поряд з поглиненими йонами Гідрогену в ґрунті знаходяться рухливі йони Алюмінію, які шкодять розвитку рослин. Алюміній найчастіше зустрічається в поглиненому стані. У нейтральному ґрунті він відсутній. Визначити кількість рухомого Алюмінію в ґрунті можна, так само як і поглинений Гідроген, за допомогою ґрунтової сольової витяжки. Для визначення обмінної кислотності і рухомого Алюмінію проф. А.В. Соколовим розроблений метод, заснований на витіснення з ґрунту Гідрогену й Алюмінію за допомогою 1н розчину калій хлориду.
Матеріали та реактиви. Колба ємністю 500 мл, дві колби по 100 мл кожна, скляна паличка, бюретка на 25 мл, сітка асбестована, штатив металічний з кільцями, воронка скляна, пальник, градуйована піпетка, фільтрувальний папір, 1% розчин фенолфталеїну в 70 ° спирті, розчини 0,02 н натрій гідроксиду і 1 н калій хлориду – 250 мл, 3,5% розчин нейтрального натрій флуориду.
Хід визначення. У колбу ємністю 500 мл поміщають 100 г повітряно-сухого ґрунту, наливають 250 мл 1н розчину калій хлориду і збовтують протягом 5 хвилин, потім розчин залишають стояти на добу. На другий день витяжку фільтрують через складчастий фільтр, причому першу порцію фільтрату виливають. Профільтровану рідину градуйованою піпеткою на 50 мл наливають у дві конічні колби.
Спочатку визначають суму обмінного Гідрогену та рухомого Алюмінію, для чого одну колбу з витяжкою нагрівають до кипіння і кип'ятять рівно 5 хвилин, після чого, не даючи охолонути розчину, додають у нього 5-7 крапель спиртового розчину фенолфталеїну. Титрують 0,02 н розчином натрій натрію до рожевого забарвлення.
Після закінчення титрування проводять підрахунок в мілліеквівалентах на 100 г ґрунту. 1 мл 0,02н розчину натрій гідроксиду відповідає 0,02 міліеквівалентам Гідрогену або Алюмінію. Для титрування використовували 50 мл витяжки, що відповідає 20 г ґрунту, так як всього було взято 100 г ґрунту і 250 мл 1 н розчину KCl. Для перерахунку на 100 г ґрунту витрачену кількість титру множать на 0,1.
Припустимо, що на титрування 50 мл сольової витяжки витрачено 12 мл 0,02 н розчину NaOH. Підставляємо дані в формулу:  = 1,2 м-екв Гідрогену і Алюмінію на 100 г ґрунту.
= 1,2 м-екв Гідрогену і Алюмінію на 100 г ґрунту.
Далі визначається обмінний Гідроген без Алюмінію, для цього Алюміній видаляється з розчину. Беруть другу колбочку з 50 мл витяжки, кип'ятять протягом 5 хвилин і охолоджують, потім в колбочку вливають 3 мл 3,5% розчину натрій флуориду натрію і осаджують Алюміній, після чого в холодному стані титрують 0,02 н розчином NaOH у присутності фенолфталеїну до рожевого забарвлення. Витрачену на титрування кількість лугу множать на коефіцієнт 0,1, що визначає кількість обмінного Гідрогену в м-екв.
Кількість активного Алюмінію в ґрунті обчислюється шляхом вирахування із загальної кількості Гідрогену і Алюмінію кількості обмінного Гідрогену в м-екв. Припустимо, що при визначенні обмінного Гідрогену було витрачено 3 мл 0,02 н розчину NaOH, то його кількість складе: 3 ∙ 0,1 = 0,3 м-екв. Тоді кількість активного Алюмінію в ґрунті дорівнюватиме: 1,2 – 0,3 = 0,9 м-екв. Необхідно ввести поправку на неповноту витіснення Гідрогену і Алюмінію, яка на підставі досвіду багатьох лабораторій ґрунтознавства була встановлена рівною 1,75. Множачи на неї отримані дані отримаємо наступну кількість обмінного Гідрогену: 0,3 м-екв × 1,75 = 0,525 м-екв і активного Алюмінію: 0,9 м-екв × 1,75 = 1,575 м-екв.
Для визначення необхідної кількості вапна на гектар орного шару землі потрібно кількість обмінної кислотності помножити на коефіцієнт 1,5.
Визначення рухомого Алюмінію в ґрунті ( метод Я.В. Пейве).
Матеріали та реактиви: технохімічні терези зна важками; воронка; штатив металевий з двома кільцями і лапкою; 10 пробірок; штатив для пробірок; колба конічна; піпетка, градуйована в 0,1 мл; мензурка на 10-12 мл з поділками в 0,1 мл; стакани хімічні на 200-500 мл, сітка асбестована; мешалка; 1 н розчин KCl (74,56 г солі розчиняють в дистильованій воді та доводять об'єм розчину до 1 л. Приготований розчин фільтрують через щільний фільтр і визначають рН. Реакція розчину повинна бути в межах 6,0-6,3 (якщо реакція інша, її регулюють); насичений розчин амоній хлориду, амоніак 25%; індикатор (конго червоний); 1% розчин амоній роданіду; 10% розчин хлоридної кислоти; 6,0 н розчин натрій гідроксиду; розчин-осаджувач Алюмінію (в 200 мл насиченого розчину амоній хлористого амонію додають мл 25% розчину амоніаку. Реакція осаджувача повинна бути в межах 7,8 - 7,9. Якщо реакція інша, її регулюють водним розчином хлоридної кислоти або амоніаку).
Хід визначення. У стакан наливають 100 мл 1 н розчину калій хлориду, всипають 40 г ґрунту, встановлюють мішалку і розмішують розчин протягом години, після чого фільтрують через складчастий фільтр. Беруть пробу на Ферум за допомогою амоній роданіду. Якщо розчин не забарвиться в червоний колір, то це означає, що Феруму в ньому немає. В іншому випадку його осаджують 6 н розчином натрій гідроксиду.
Для визначення Алюмінію миють 9 пробірок і споліскують дистильованою водою, потім їх встановлюють у штатив і пронумеровують. За допомогою градуйованої піпетки в пробірки наливають сольову витяжку (табл.).
Таблиця
| Номери пробірок | |||||||||
| Кількість витяжки в мл | 2,5 | 1,8 | 1,5 | 1,2 | 1,0 |
У всі пробірки, крім першої, доливають до об’єму 5 мл 1 н розчин калій хлориду. У кожну пробірку додають по 1 мл осаджувача. Пробірку струшують і додають по одній краплі індикатора – конго червоного. Вміст пробірок добре перемішують, і всі 9 пробірок поміщають на 10 хвилин у киплячу баню. Після кип'ятіння пробірки залишають на 30-35 хвилин для охолодження, після чого приступають до спостереження за осадом. Знаходять першу пробірку, в якій немає осаду, концентрація Алюмінію в цій пробірці дорівнює за даних умов 0,0013 мг алюмінію в 1 мл розчину. Вміст Алюмінію в ґрунті можна обчислити за таблицею.
Таблиця
| № пробірки | Об’єм витяжки в мл | Алюмінію на 100 г ґрунту в мг |
| 5,0 | 0,39 | |
| 4,0 | 0,48 | |
| 3,0 | 0,65 | |
| 2,5 | 0,78 | |
| 2,0 | 0,97 | |
| 1,8 | 1,08 | |
| 1,5 | 1,30 | |
| 1,2 | 1,65 | |
| 1,0 | 1,95 |
Якщо осад випадає і в пробірці № 9, то фільтрат, який залишився, розбавляють 1 н розчином калій хлориду та виконують нове визначення Алюмінію. При розрахунку необхідно врахувати здійснене розбавлення.
Заходом боротьби з рухомим Алюмінієм є вапнування. Можна розрахувати необхідну кількість вапна, знаючи кількість мг рухомого Алюмінію. Припустимо, що аналіз показав відсутність осаду і каламуті в пробірці № 7. По таблиці 6 знаходимо кількість Алюмінію в 100 г ґрунту, воно дорівнює 1,3 мг. Множимо 1,3 мг на коефіцієнт 4,4. Таким чином, для нашого ґрунту необхідна наступна кількість вапна: 1,30 ∙ 4,4 = 5,72 центнера СаСО3 на гектар, а на 1 м2 потрібно 572 кг: 1000 = 57,2 г.
Визначення гідролітичної кислотності. Гідролітична кислотність завжди вище обмінної кислотності і нерідко спостерігається в таких ґрунтах, де обмінна кислотність відсутня. Гідролітична кислотність виявляється за допомогою розчину натрій ацетату або кальцій ацетату та подальшого титрування етанової кислоти лугами (метод Каппена).
Матеріали та реактиви: бюретка на 25 мл; колба на 250 мл; штатив металічний; стаканчик на 50 мл; конічна колба на 100 мл; піпетка на 10 мл; терези з наважками; мензурка; ложка порцелянова; паличка скляна; сушильна шафа; 1н розчин натрій ацетату; 0,1 н розчин натрій гідроксиду; розчин 0,1% фенолфталеїну в 90° спирті.
Хід визначення. 40 г повітряно-сухого ґрунту поміщають в колбу ємністю 250 мл і наливають туди ж 100 мл розчину натрій ацетату, потім ретельно перемішують протягом 5 хвилин і дають розчину відстоятися. Через добу рідину фільтрують через складчастий фільтр, обережно за допомогою піпетки відливають 50 мл витяжки і титрують 0,1 н розчином натрій гідроксиду в присутності 5-7 крапель фенолфталеїну. Щоб титрування проходило правильно, розчин весь час перемішують.
Для обчислення гідролітичної кислотності потрібно об’єм 0,1 н розчину натрій гідроксиду, який пішов на титрування, помножити на 0,875 (коефіцієнт перерахунку). Наприклад, на титрування 50 мл витяжки (20 г ґрунту) було витрачено 1,2 мл NaOH. Визначаємо величину м-екв гідролітичної кислоти на 100 г ґрунту: 1,2 ∙ 0,875 = 1,05 м-екв. Щоб з'ясувати кількість вапна для нейтралізації 1 га ґрунту, множимо отриманий результат на 1,5. Отримуємо 1,575 т.
ПРАКТИЧНА РОБОТА «Визначення гумусу в ґрунті за методом Тюріна»
Метод заснований на окиснюванні гумусу ґрунту розчином калій біхромату в сульфатній кислоти з наступним визначенням тривалентного Хрому, еквівалентного вмісту гумусу, на фотоелектроколориметрі. Сумарна похибка методу, виражена коефіцієнтом варіації, становить, % (відн.): 10 – для діапазону вмісту гумусу до 5%; 5 – для діапазону вмісту гумусу більше 5%.
Методика відбору проб. Зразки ґрунту доводять до повітряно-сухого стану, подрібнюють і пропускають крізь сито з круглими отворами діаметром 1-2 мм. Коріння і рослинні залишки, що залишилися на ситі, видаляють. Зразки зберігають в коробках або пакетах. З розмеленого ґрунту відбирають пробу масою 3-5 г для тонкого подрібнення. При відборі проби з коробки ґрунт ретельно перемішують на всю глибину коробки. З пакетів ґрунт висипають на рівну поверхню, розподіляють шаром не більше 1 см і відбирають проби не менше ніж з п'яти місць. Відібрану пробу подрібнюють і просівають крізь сито з розміром отворів 0,25 мм. Для тонкого подрібнення використовують ступки і подрібнювальні пристрої з порцеляни, сталі та інших твердих матеріалів. Подрібнену пробу ретельно перемішують, розподіляють тонким шаром на рівній поверхні і відбирають пробу для аналізу не менш як з п'яти місць.
Прилади та обладнання: фотоелектроколориметр; баня водяна; терези лабораторні; дозатори та піпетки місткістю 25 і 100 мл; груша гумова зі скляною трубкою або пристрій для барботації; ступка порцелянова з товкачиком; палички скляні; циліндри; колби конічні місткістю 250 мл; пробірки; папір фільтрувальний.
Реактиви: сіль Мора (подвійна сіль FeSO4·(NH4)2SO4·6H2O) або ферум(ІІ) сульфат септагідрат (FeSO4·7H2O); калій гідроксид; калій дихромат; розчин калій перманганату, 0,1 н.; натрій сульфіт або натрій сульфіт септагідрат.
Підготовка до аналізу.
Приготування хромової суміші. 40 г тонко подрібненого калій дихромату розчиняють в дистильованої воді, доводячи об'єм до 1000 мл, ретельно перемішують і переливають у колбу з термостійкого скла місткістю 3000 мл. До отриманого розчину обережно доливають невеликими порціями по 100 мл, з інтервалом в 10-15 хв, 1000 мл сульфатної кислоти. Колбу з розчином накривають скляною лійкою і залишають до повного охолодження. Розчин зберігають необмежено довго у склянці з притертою пробкою.
Приготування розчину відновника. 40 г солі Мора або 27,8 г FeSO4·7H2O, розчиняють в 700 мл розчину сульфатної кислоти з концентрацією 0,5 моль/л. Розчин фільтрують через подвійний складчастий фільтр в мірну колбу, доводять об'єм до 1000 мл дистильованою водою, і ретельно перемішують.
Концентрацію розчину перевіряють кожні 3 дні по 0,1 н. розчину калій перманганату. Для цього у три конічні колби наливають за допомогою піпетки по 10 мл розчину солі Мора (або ферум(ІІ) сульфату септагідрату). Доливають в кожну колбу по 1 мл концентрованої сульфатної кислоти та 50 мл дистильованої води, потім відтитровують 0,1 н. розчином калій перманганату до слабо-рожевого забарвлення, яке не зникає протягом 1 хв. Для обчислення коефіцієнта поправки використовують середнє арифметичне результатів трьох титрувань. Коефіцієнт поправки (К) обчислюють за формулою:
К = 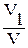 , де
, де
V1 – об'єм розчину калій перманганату, витраченого на титрування, мл;
V – об'єм розчину солі Мора (або ферум(ІІ) сульфату септагідрату), взятого на титрування, мл.
Розчин зберігається не тривалий час. Для оберігання розчину від окиснення киснем повітря до бутлі приєднують склянку Тищенко з лужним розчином натрій сульфіту.
Приготування лужного розчину натрій сульфіту. 40 г безводного натрій сульфіту або 80 г натрій сульфіту септагідрату розчиняють в 700 мл дистильованої води. 10 г калій гідроксиду, розчиняють в 300 мл дистильованої води. Отримані розчини змішують.
Проведення аналізу.
Окиснення гумусу ґрунту. Масу проби ґрунту для аналізу визначають виходячи з передбачуваного вмісту гумусу в ґрунті. Маса проби для аналізу ґрунтів становить:
з вмістом гумусу більше 7% – 50-100 мг;
4-7% – 100-200 мг;
2-4% – 250-350 мг;
до 2% – 500-700 мг.
Проби ґрунту поміщають в пробірки, встановлені в штативи та підписують. У пробірки з аналізованими пробами і в дев'ять чистих пробірок для приготування розчинів порівняння доливають за допомогою піпетки по 10 мл хромової суміші та поміщають в них скляні палички.
Ґрунт з хромової сумішшю ретельно перемішують. Потім пробірки занурюють у киплячу водяну баню і витримують у ній протягом 1 год з моменту закипання води в бані після занурення пробірок. Рівень хромової суміші в пробірках повинен бути на 2-3 см нижче рівня води в бані. Вміст пробірок перемішують скляними паличками через кожні 20 хв. Після закінчення кип’ятіння пробірки виймають і занурюють у водяну баню з холодною водою. Після охолодження в пробірки з пробами ґрунту доливають дозатором по 40 мл дистильованої води, а в пробірки для приготування розчинів порівняння доливають розчин відновника і дистильовану воду в об’ємах, зазначених у табл.
Таблиця
| Характеристика розчину | Номер розчину порівняння | ||||||||
| Об'єм дистильованої води, мл | |||||||||
| Об'єм розчину відновника, мл | |||||||||
| Маса гумусу, яка відповідає об’єму відновника в розчині порівняння, мг | 1,03 | 2,07 | 4,14 | 5,17 | 7,76 | 10,3 | 12,9 | 15,5 |
Потім з пробірок виймають скляні палички і ретельно перемішують вміст барбатацією повітря, що нагнітається гумовою грушею через скляну трубку. Розчини залишають для осідання ґрунтових частинок і повного освітлення.
Визначення гумусу. Розчини порівняння і розчини, що досліджуються, фотометрують в кюветі з товщиною просвічувати шару 10-20 мм щодо розчину порівняння № 1 при довжині хвилі 590 нм, або використовуючи оранжево-червоний світлофільтр з максимумом пропускання в області 560-600 нм. Розчин в кювету фотоелектроколориметра переносять обережно, не піднімаючи осад на дні пробірки.
Обробка результатів.
За результатами фотометрування розчинів порівняння будують градуювальний графік. По осі абсцис відкладають масу гумусу в міліграмах, яка відповідає об’єму відновника в розчинах порівняння, а по осі ординат відповідні їм показання приладу. Користуючись градуювальним графіком, за результатами аналізу визначають масу гумусу в аналізованих пробах.
Масову частку гумусу (X) у відсотках обчислюють за формулою:
 , де
, де
А – маса гумусу в аналізованій пробі, знайдена за графіком, мг;
К – коефіцієнт поправки до концентрації відновника;
m – маса проби ґрунту, мг;
100 – коефіцієнт перерахунку у відсотки.
За результат аналізу приймають значення одиничного визначення гумусу. Результат аналізу округлюють до сотих часток відсотка – при вмісті гумусу до 10% і до десятих часток відсотка – при вмісті гумусу більше 10%.
ПРАКТИЧНА РОБОТА «Визначення нафтопродуктів у воді методом паперової хроматографії»
Нафтопродукти належать до числа найбільш поширених і небезпечних речовин, що забруднюють поверхневі води. Великі кількості нафтопродуктів надходять у поверхневі води при перевезенні нафти водним шляхом, транспортуванні по трубопроводах, зі стічними водами підприємств нафтовидобувної, нафтопереробної, хімічної, металургійної галузей промисловості, з господарсько-побутовими водами. Нафта та продукти її переробки є надзвичайно складною, непостійною за складом і різноманітною сумішшю речовин. До її складу входять низько- і високомолекулярні граничні, ненасичені аліфатичні, нафтенові, ароматичні вуглеводні; оксигено-, нітрогено- і сульфурвмісні сполуки; ненасичені гетероциклічні сполуки типу смол, асфальтенів, ангідридів, асфальтенових кислот та ін.
Нафтопродукти знаходяться в різних міграційних формах: розчиненої, емульгованої, сорбованої на твердих частках суспензій і донних відкладень, у вигляді плівки на поверхні води. Зазвичай в момент надходження у водойму маса нафтопродуктів зосереджена в плівці. У міру віддалення від джерела забруднення або з плином часу відбувається перерозподіл нафтопродуктів між основними формами, що проходить стадії переходу з послідовним підвищенням частки розчинених, емульгованих, сорбованих нафтопродуктів.
Наявність нафтопродуктів у вигляді плівки негативно позначається як на якості води, так і на стані водойми в цілому, на флорі і фауні. У присутності нафтопродуктів вода набуває специфічного смаку і запаху, змінюється її колір, рН, погіршується газообмін з атмосферою, порушуються процеси самоочищення водойми.
Метод визначення вмісту олій і нафтопродуктів у воді заснований на їх попередній концентрації шляхом екстрагування з водного середовища неполярним розчинником – тетрахлорметаном у кислому середовищі при рН 3-4 з подальшим аналізом екстракту. Аналіз екстракту виконується напівкількісним методом паперової хроматографії, який заснований на використанні відмінності коефіцієнтів розподілу (здатності сорбуватись) компонентів аналізованого розчину. Різні величини коефіцієнтів розподілу забезпечують поділ суміші в екстракті.
Чутливість виявлення нафтопродуктів становить 1 мг/л. Діапазон визначуваних концентрацій нафтопродуктів у воді – від 1 до 20 мг/л, тривалість виконання аналізу – не більше 3 годин (включаючи стадію екстракції проби).
Матеріали та обладнання: ділильна воронка, плоскодонна колба, скляна бутиль, холодильник, колонка з сорбентом, колба, бюкс, вентилятор, піпетка-крапельниця, хроматографічний стакан, хроматографічний папір, універсальний індикаторний папір, хлоридна кислота густиною 1,19 г/мл, гексан, тетрахлорметан, петролейний ефір, прожарений натрій сульфат.
Відбір проб. Об’єм відібраної проби води визначається величиною очікуваної концентрації нафтопродуктів у воді (табл.).
Таблиця
| Величина очікуваної концентрації нафтопродуктів у воді, мг/л | Об’єм відібраної проби, л |
| 1-5 | 0,5 |
| 5-20 | 0,2 |
Проведення екстракції. Екстракцію проводять в ділильної воронці або в посудині достатньої місткості (плоскодонній колбі, скляному бутлі). У посудину з пробкою (ділильну воронку, плоскодонну колбу, скляну пляшку тощо) помістіть відповідну пробу аналізованої води. Проба повинна займати не більше ⅓ об’єму посудини. До пробі додайте 2-3 краплі розчину хлоридної кислоти до рН 3-4 (значення рН контролюйте за універсальним індикаторним папером). Додайте до проби за допомогою піпетки 10 мл тетрахлорметану. Проведіть екстракцію, для чого інтенсивно перемішуйте вміст посудини протягом 3-5 хв. Залиште посудину у вертикальному положенні на 10-20 хвилин для розшарування рідини.
Нижній шар з невеликою кількістю води перенесіть в ділильну воронку з набору (верхній водний шар відкидають). Воронку залиште у вертикальному положенні на 10-20 хвилин. Відокремте екстракт від залишків води, зливши його в склянку для зберігання екстракту (екстракти можна зберігати в герметично закритих склянках в прохолодному місці у вертикальному положенні до 2 місяців).
 Аналіз екстракту. Зі склянки з екстрактом піпеткою-крапельницею відберіть 1 мл екстракту і перенесіть в стаканчик для хроматографування. У стаканчик з екстрактом помістіть смужку хроматографічного паперу під кутом таким чином, щоб нижній кінець смужки упирався в протилежну стінку стаканчика, а верхній край смужки виступав вище краю стаканчика на 2-3 мм.
Аналіз екстракту. Зі склянки з екстрактом піпеткою-крапельницею відберіть 1 мл екстракту і перенесіть в стаканчик для хроматографування. У стаканчик з екстрактом помістіть смужку хроматографічного паперу під кутом таким чином, щоб нижній кінець смужки упирався в протилежну стінку стаканчика, а верхній край смужки виступав вище краю стаканчика на 2-3 мм.
Рис. Визначення вмісту нафтопродуктів методом паперової хроматографії: а – положення смужки в стаканчику при хроматографуванні; б – розташування плями нафтопродуктів на смужці після хроматографування; 1 – стаканчик; 2 – смужка; 3 – пляма нафтопродуктів; 4 – межа занурення смужки; 5 – екстракт.
Нахиляння та струшування (хитання основи) під час хроматографування можуть призвести до неправильного результату при аналізі. Для підвищення надійності результатів доцільно виконувати аналіз 2 проб води одночасно. При цьому необхідно забезпечити однакові умови при хроматографуванні екстракту (температуру, швидкість обдування стаканчика повітрям тощо).
Витримайте смужку паперу до повного випаровування розчинника (близько 3 годин). Лінійкою виміряйте ширину плями нафтопродуктів на смужці. За допомогою градуювального графіка (рис.) визначте масу нафтопродуктів в пробі. Концентрацію нафтопродуктів у пробі води (СНП, мг/л) розрахуйте за формулою:
 , де
, де
V – об'єм води, взятий на аналіз, мл;
mНП – маса нафтопродуктів в пробі, мг.

Рис. Залежність ширини плями від маси нафтопродуктів у пробі (градуйований графік).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1047; Нарушение авторских прав?; Мы поможем в написании вашей работы!