
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота №8
|
|
|
|
ГІДРОКСИКИСЛОТИ. АЛЬДЕГІДОКИСЛОТИ. КЕТОКИСЛОТИ
1. Якісна реакція на a- оксикислоти з FeCl3
Реактиви: різні органічні кислоти: лимонна, винна, яблучна, щавлева, розчин FeCl3, 5% розчин фенолу, сироватка молочна або капустяний розсіл.
Приготувати розчин, що складається з розчину FeCl3 і розчину фенолу до появи фіолетового забарвлення. Приготувати розчини кислот і додати до них 2-3 краплі розчину хлориду заліза з фенолом. У пробірках із a- оксикислотами виникає зелено-жовте забарвлення. Перевірте присутність молочної кислоти в молочній сироватці або капустяному розсолі. Утвориться лактат заліза. Ця реакція використовується для виявлення молочної кислоти в шлунковому соці.
L-оксикислоти утворюють стійкі комплексні солі заліза, а також паралельно відбувається окиснення гідроксикислот та відновлення заліза (ІІІ) до іону заліза (ІІ). Наприклад, у випадку винної кислоти утворюється комплекс: Н

 |
|

 ООС – СН– О О – СН– СОО
ООС – СН– О О – СН– СОО



 | Fe 2+ |
| Fe 2+ |
 ООС – СН–О О – СН– СОО
ООС – СН–О О – СН– СОО
|
Н
2.Розкладання молочної кислоти
Реактиви: концентрована H2SO4, аміачний розчин нітрату срібла.
У пробірку помістити 0,5 мл молочної кислоти і 1 мл концентрованої H2SO4. Пробірку закрити газовідвідною трубкою. Суміш нагріти до кипіння. Підпалити з кінця газовідвідну трубку. Про що говорить блакитне полум'я? На підставі спостережень зробити висновок про розкладання молочної кислоти при нагріванні, зважаючи на те, що при нагріванні кислоти утвориться альдегід і кислота.


 СН3– СН– С = О t СН3 – С= О + Н– С= О
СН3– СН– С = О t СН3 – С= О + Н– С= О
 | ОН Н ОН
| ОН Н ОН
ОН
 У присутності концентрованої сульфатної кислоти з мурашиної утворюється оксид вуглецю: Н– С= О H2SO4 H2O + CO2
У присутності концентрованої сульфатної кислоти з мурашиної утворюється оксид вуглецю: Н– С= О H2SO4 H2O + CO2
 ОН
ОН
А оцтовий альдегід полімеризується в паральдегід:
 3СН3 – С= О
OH 3СН3 – С= О
OH 
| 
|
3. Окислення молочної кислоти у піровиноградну
Реактиви: молочна кислота, розчин КМnО4, концентрована СН3СООН, фенілгідразин, нітропрусид натрію, луг.
1г молочної кислоти нейтралізують розчином соди (проба на лакмусовий папір), додають 5 мл концентрованого розчину КМnО4. Суміш нагріти до кипіння.
Осад відфільтрувати. Фільтрат розділити на дві частини. У одній частині довести наявність кетогрупи, для чого до фільтрату додати декілька крапель свіжо приготованого розчину нітропрусиду натрію. При додаванні розчину лугу суміш забарвлюється в червоний колір, що поступово переходить у жовтогарячий. При додаванні концентрованої оцтової кислоти колір стає вишнево-червоним. До іншої частини фільтрату додати оцтової кислоти і декілька крапель розчину фенілгідразону в оцтовій кислоті. Утвориться осад фенілгідразину піровиноградної кислоти. Відбувається заміщення кисню в карбонільній групі. Рівняння реакції.
При окисненні молочної кислоти марганцевокислим калію в лужному середовищі утворюється піровиноградна кислота:
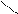

 СН3–СН–С=О+2KMnO4+2KOH→K2MnO4++СН3–С–С =О+2H2O
СН3–СН–С=О+2KMnO4+2KOH→K2MnO4++СН3–С–С =О+2H2O
| OH || OH
OH O
4. Утворення кислої і середньої солі винної кислоти
Реактиви: 5% розчин винної кислоти, 0,1н розчин КОН.
До 1,0 мл. кислоти доливають при струшуванні декілька крапель їдкого калію до утворення осаду кислої солі. До отриманого осаду додати надлишок їдкого калію до розчинення осаду.
HO–HC–COOH HO–HC–COOK
| + KOH → | + H2O
HO–HC–COOH HO–HC–COOH
HO–HC–COOK HO–HC–COOK
| + KOH → |
HO–HC–COOH HO–HC–COOK
5. Доведення наявності оксигруп у винній кислоті
Реактиви: 5% CuSO4, 2н розчин NaOH, розчин середньої калієвої солі винної кислоти (попередній дослід).
До кількох крапель сульфату міді долити надлишок їдкого натрію до утворення синього осаду. До отриманого осаду долити надлишок, отриманий у попередньому досліді, розчину середньої солі винної кислоти.
Гідроксид міді розчиняється і утворюється темно-синя прозора рідина: Н
|

 Cu(OH)2 + HO–HC–COOK KOOC– CH–O O–HC–COOK
Cu(OH)2 + HO–HC–COOK KOOC– CH–O O–HC–COOK


 | - H2O | Cu |
| - H2O | Cu |
HO–HC–COOK KOOC– CH–O O–HC–COOK
|
Н
Комплексна сполука міді легко окиснює альдегіди, відновлюючи цукри з виділенням осаду оксиду міді (І). Для приготування комплексної солі міді в цьому випадку використовується змішана калієво-натрієва сіль винної кислоти, так звана сегнетова сіль. Одержаний з неї розчин комплексної солі міді називають Фелінговою рідиною.
6. Розкладання лимонної кислоти
Реактиви: лимонна кислоти кристалічна, концентрована вапняна вода, концентрована H2SO4, розчини йоду, NaOH.
У суху пробірку помістити лопаточку лимонної кислоти і 20-30 крапель концентрованої H2SO4. Закрити пробірку газовідвідною трубкою. Газовідвідну трубку опустіть спочатку в пробірку з вапняною водою, а потім у пробірку з лужним розчином йоду. В першій пробірці утворюється осад СаСО3, а в другій жовтий осад йодоформу.
Нагріти суміш лимонної і сірчаної кислот.
а) підпаліть газ, що виділяється, з отвору газовідвідної трубки. Який можна зробити висновок на підставі забарвлення полум'я в блакитний колір?
б) про що говорить помутніння вапняної води?
в) відігнати декілька крапель дистиляту у свіжо приготований розчин нітропрусиду натрію і додати декілька крапель гідроксиду натрію. З'являється оранжево-червоне забарвлення, що при підкисленні оцтовою кислотою переходить у вишнево-червоне. Висновок.
CH2–COOH CH2–COOH
| |
 НО – CH– COOH t C= O + H–COOH
НО – CH– COOH t C= O + H–COOH
| |
CH2 –COOH CH2 –COOH
Лимонна кислота Ацетодикарбонова кислота
 H–COOH t CO + H2O
H–COOH t CO + H2O
Ацетодикарбонова кислота декарбоксилюється, утворюючи ацетон:
CO (CH2–COOH)2 → CH3– C–CH3 + 2CO2
| |
O
CO2 + Ca(OH)2→ CaCO3 ¯ + H2O
CH3– C–CH3 + 3 NaOI → CHI3 + CH3–COONa + 2 NaOH
| |
O
7. Взаємодія галової кислоти і таніну з FeCl3
Реактиви: 1% розчин галової кислоти, водний розчин таніну, 2% розчин FeCl3.
У одну пробірку внести 1,0 мл 1% розчину галової кислоти. У другу стільки ж таніну. У кожну з них додати по декілька крапель 2 % розчинуFeCl3. При цьому розчин галової кислоти забарвлюється в зелено-чорний колір, а розчин таніну - у синьо-чорний. Про що свідчить реакція зазначених сполук із FeCl3?
Завдання для самостійної роботи
1. Зазначте можливість існуваня оптичних ізомерів у сполуках: -a-хлорпропіоновій кислоті, b- хлорпропіоновій кислоті.
2. 



 Здійсніть ланцюг перетворень: CH3COH HCN А + H2O B CH3COOH С + СН3СН3ОН D. Назвіть всі сполуки.
Здійсніть ланцюг перетворень: CH3COH HCN А + H2O B CH3COOH С + СН3СН3ОН D. Назвіть всі сполуки.
3. Виходячи з толуолу, одержати кислоти:
а) пара-нітробензойну
б) мета-нітробензойну
г) орто-хлорбензойну.
4. Напишіть рівняння реакцій:
а) взаємодії яблучної кислоти з 2 молекулами етилового спирту;
б) взаємодії бензойної і саліцилової кислот з бромом;
в) гідролізу аспірину.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 752; Нарушение авторских прав?; Мы поможем в написании вашей работы!