
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
РОЗЧИНИ 1 страница
|
|
|
|
1.4.1. Розчин, в якому речовина при певній температурі більше не розчиняється, називають:
а) насичений; б) ненасичений;
в) розведений; г) пересичений.
1.4.2. В шлунковому соці людини розчиненою речовиною є:
а) соляна кислота; б) натрій гідроксид;
в) вода; г) сірчана кислота.
1.4.3. Щоб збільшити розчинність газу, треба:
а) понизить температуру;
б) підвищити температуру;
в) підвищити тиск; г) понизить тиск.
1.4.4. При збільшенні температури, розчинність речовини:
а) зменшується; б) збільшується;
в) не змінюється;
г) спочатку збільшується, а потім зменшується.
1.4.5. Тиск впливає на розчинність речовини:
а) рідкої; б) твердої;
в) газоподібної; г) нерозчинної.
1.4.6. Вибрати фактор, який збільшує розчинність твердих речовин:
а) пониження температури;
б) підвищення температури;
в) підвищення тиску; г) пониження тиску.
1.4.7. Хлорид натрію розчиняється у воді і не розчиняється в бензолі. Це пояснюється:
а) різною природою хімічного зв’язку у молекулах води і бензолу;
б) різною густиною води і бензолу;
в) різними ступенями окиснення атомів гідрогену у воді і у бензолі;
г) різними молярними масами у води і бензолу.
1.4.8. Вибрати формулу для знаходження масової концентрації розчину:
а) Cm = 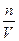 ; б)
; б) 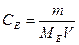 ;
;
в) Cн = 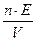 г) ω =
г) ω = 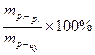
1.4.9. Вибрати формулу для знаходження молярної концентрації розчину:
а)  ; б)
; б) 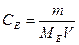 ;
;
в) Cн = 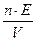 г) ω =
г) ω = 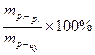
1.4.10. Вибрати формулу для знаходження молярної концентрації еквівалентів розчину:
а) Cm = 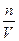 ; б)
; б) 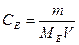 ;
;
в) Cн = 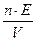 г) ω =
г) ω = 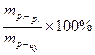
1.4.11. Формула для обчислення моляльності водних розчинів:
а) Сm = 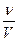 ; б) Bx =
; б) Bx =  ;
;
в) 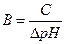 ; г) ω =
; г) ω = 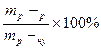 ;
;
1.4.12. Моляльна концентрація (моляльність) – це відношення кількості розчиненої речовини (моль) до:
а) маси розчину; б) об’єму розчину;
в) маси розчинника; г) об’єму розчинника.
1.4.13. Масова частка розчиненої речовини в розчині позначається як:
а) ν; б) СМ; в) ρ; г) ω.
1.4.14. Масова частка розчиненої речовини в розчині виражається в:
а) г/л; б) моль/л; в) г/дм3; г) %.
1.4.15. “Визначити масову частку речовини в розчині” означає:
а) знайти масу речовини, розчинену в 100 г води;
б) знайти масу речовини, розчинену в 100 г розчину;
в) знайти масу речовини в певній масі розчину;
г) знайти масу речовини в певному об’ємі розчину.
1.4.16. Молярна концентрація розчиненої речовини позначається як:
а) ν; б) СМ; в) ρ; г) ω.
1.4.17. Молярна концентрація розчиненої речовини виражається в:
а) г/л; б) моль/л;
в) г/дм3; г) відсотках (%)
1.4.18. Вибрати позначення одномолярного розчину:
а) 1 М; б) 2 н; в) 1 дм3; г) 1%.
1.4.19. Титр розчину визначає:
а) кількість г в 1 мл розчину;
б) кількість молів в 1 л розчину;
в) кількість г в 100 мл розчину;
г) кількість г в 1 л розчину.
1.4.20. Фізіологічний розчин – це:
а) 0,5%- розчин NaCl; б) 5%- розчин NaCl;
в) 0,9%- розчин NaCl; г) 8%- розчин глюкози.
1.4.21. Фізіологічний розчин – це:
а) 0,5%- розчин NaCl; б) 5%- розчин NaCl;
в) 9%- розчин NaCl; г) 5%- розчин глюкози.
1.4.22. Який фактор еквівалентності для сполуки фосфатної кислоти в реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.23. Який фактор еквівалентності для сульфатної кислоти в реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.24. Який фактор еквівалентності для сполуки гідроксиду хрому (ІІІ) в реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.25. Який фактор еквівалентності для сполуки гідроксиду амонію в реакція, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.26. Який фактор еквівалентності для сполуки натрію хлориду в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.27. Який фактор еквівалентності для натрію карбонату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.28. Який фактор еквівалентності для натрію гідрокарбонату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.29. Який фактор еквівалентності для сполуки хлориду алюмінію:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.30. Який фактор еквівалентності для сполуки хлориду барію в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.31. Який фактор еквівалентності для сполуки купруму сульфату в реакціях обміну, які йдуть до кінця:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.32. Який фактор еквівалентності для амонію сульфату:
а) 1/1; б) ½; в) 1/3; г) ¼.
1.4.33 Молярна маса еквіваленту сульфатної кислоти в реакціях повного йонного обміну становить (в г/моль):
а) 98; б) 4,9; в) 49; г) 9,8.
1.4.34. Молярна маса еквіваленту фосфатної кислоти в реакціях повного йонного обміну становить (в г/моль):
а. 98; б. 49; в. 24,5; г. 32,67.
1.4.35. Молярна маса еквіваленту гідроксиду амонію в реакціях обміну становить (в г/моль):
а) 78; б) 39; в) 35; г) 19,5.
1.4.36. Молярна маса еквіваленту сульфату амонію в реакціях обміну рівна (в г/моль):
а) 114; б) 57; в) 342; г) 171.
1.4.37. Молярна маса еквіваленту фосфату кальцію в реакціях повного йонного обміну становить (в г/моль):
а) 51,67; б) 310; в) 155; г) 103,33;
1.4.38. В хірургії для дезінфекції рук використовують розчин:
а) мурашиної кислоти; б) NaОН;
в) NaCl; г) Н2SО4;
1.4.39. Тимчасова твердість води зумовлена наявністю у природній воді слідуючих солей кальцію та магнію
а) гідрокарбонатів
б) сульфатів;
в) хлоридів;
г) нітратів.
1.4.40. При зберіганні відкритої колби з розчином солі на дні колби утворились кристали. Яким буде розчин над кристалами?
а) Насиченим; б) Ненасиченим;
в) Пересиченим; г) Розбавленим.
1.4.41. Вода з високою твердістю непридатна для використання у фармацевтичній промисловості. Які з наведених речовин можна використати з метою пом’якшення води?
а) Na2CO3, NaOH
б) CaCO3, Ca(OH)2
в) Na3PO4, CaCl2
г) MgSO4, H2SO4
1.4.42. Природна вода завжди містить розчинені солі. Яка з наведених солей може зумовлювати тимчасову твердість води?
а) Mg(HCO3)2; б) NaCl;
в) CaСl2; г) MgCl2
1.4.43. Для приготування 1 л 0,1 М розчину сульфатної кислоти (М(H2SO4)=98 г/моль) необхідно взяти:
а) 9,8 г H2SO4; б) 980 г NaCl;
в) 0,098 г NaCl; г) 49 г NaCl
1.4.44. Вкажіть речовину яка має однакові значення молярної та еквівалентної мас:
а) HCl; б) Na2SO4;
в) H3PO4 г) Al2(SO4)3
1.4.45. Нашатирний спирт – це водний розчин з масовою часткою аміаку:
а) 10%; б) 3%;
в) 5%; г) 15%
1.4.46. Для приготування 500 г 10% гіпертонічного розчину натрію хлориду необхідно:
а) 50 г NaCl; б) 0,5 г NaCl
в) 25 г NaCl; г) 75 г NaCl
1.4.47. У середньому людина вживає 6-7 кг кухонної солі на рік. Яка маса іонів хлориду вводиться в організм людини щоденно, якщо вважати, що людина з`їла впродовж року приблизно 5,85 кг NaCl?
а) ~ 10 г; б) ~ 1 г;
в) ~ 0,6 г; г) ~ 6 г.
1.4.48. Розрахуйте масу натрій хлориду для приготування 100 г ізотонічного (0,9\%) розчину, який використовують для внутрішньовенного введення.
а) 0,9 г; б) 1,8 г;
в) 18 г; г) 0,36 г
1.4.49. Фактор еквівалентності кислот – це одиниця поділена на
а) валентність кислотного залишку;
б) число атомів гідрогену, що заміщується на метал;
в) число атомів гідрогену, що входить до кислоти.
1.4.50. Фактор еквівалентності основ – це одиниця поділена на:
а) валентність оксигруп; б) число атомів металу; в) число оксигруп.
1.4.51. Фактор еквівалентності солей – це одиниця поділена на:
а) валентність металу;
б) ступінь окислення металу;
в) сумарну валентність металу.
1.4.52. Фактор еквівалентності в окисно – відновних реакціях – це одиниця
поділена на:
а) число електронів, що приймає окисник, або віддає відновник;
б) число електронів, що бере участь в реакції;
в) зміна ступеня окиснення.
1.4.53. Молярна маса еквіваленту – це:
а) добуток молярної маси речовини на фактор еквівалентності;
б) добуток маси речовини на фактор еквівалентності;
в) відношення молярної маси речовини до фактору еквівалентності.
1.4.54. Молярна концентрація еквіваленту – це:
а) відношення маси еквівалента речовини до об’єму розчину;
б) кількість речовини в одиниці об’єму розчину;
в) кількість моль еквівалентів речовини в одиниці об’єму розчину.
1.4.55. За законом еквівалентів:
а) 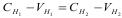
б) 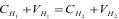
в) 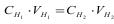
г)
1.5. ОСНОВИ ТИТРИМЕТРИЧНОГО АНАЛІЗУ
1.5.1. В титриметричному методі аналізу використовується вимірювання:
а) маси; б) об’єму;
в) тиску; г) температури.
1.5.2. Який мірний посуд застосовують для виміру об’єкту титранту:
а) мензурка; б) мірна колба;
в) бюретка; г) мірний циліндр.
1.5.3. Стандартний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.3. Досліджуваний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.4. Що таке титрований розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.4. Що таке досліджуваний розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.5. В титриметричних методах аналізу концентрацію робочого розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.6. В титриметричних методах аналізу концентрацію досліджуваного розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.7. Закон еквівалентів визначає відношення між кількістю еквівалентів досліджуваної речовини і стандартного розчину:
а) більше стандартного розчину;
б) більше досліджуваної речовини;
в) однакове;
г) менше стандартного розчину.
1.5.8. Закон еквівалентів для будь-якої пари взаємодіючих речовин можна виразити:
а) 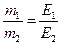 ; б)
; б) 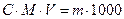 ;
;
в) 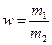 б)
б) 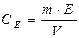 .
.
1.5.9. Математичний вираз закону еквівалентів:
а) СЕ1∙V1 = CE2∙V2; б) 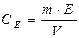 ;
;
в) 
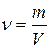 ; г)
; г)  .
.
1.5.10. Титр розчину виражають в:
а) г/л; б) моль/л;
в) г/мл; г) г/моль
1.5.11. Молярну концентрацію еквіваленту речовини в розчині виражають в:
а) моль/л; б) г/моль;
в) г/мл; г) моль/кг.
1.5.12. Точкою еквівалентності називають момент реакції, коли:
а) припинено титрування;
б) спостерігається зміна середовища;
в) кількість еквівалентів досліджуваного і робочого розчину однакова;
г) кількість еквівалентів досліджуваного і робочого розчину різна.
1.5.13. Встановити точку еквівалентності в методі нейтралізації можна за допомогою:
а) зміни забарвлення індикатора;
б) нагрівання; в) перемішування;
г) додавання відповідного реагенту.
1.5.14. Індикатори – це органічні барвники складної будови, які змінюють своє забарвлення залежно від:
а) нагрівання; б) охолодження;
в) рН-розчину; г) концентрації.
1.5.15. Зміна забарвлення індикатора при кислотно-основному титруванні показує:
а) середовище розчину;
б) точку еквівалентності;
в) кількість кислоти; г) кількість лугу.
1.5.16. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) нейтральному; г) слабо основному.
1.5.17. В якому середовищі буде точка еквівалентності при титруванні слабкої кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
1.5.18. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти слабкою основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
2.5.14. В якому випадку скачок рН при титруванні буде зміщуватись в лужну сторону?
а) при титруванні слабкої кислоти лугом;
б) при титруванні сильної кислоти лугом;
в) при титруванні слабкої кислоти слабкою основою;
в) при титруванні сильної кислоти слабкою основою;
2.5.15. Точка еквівалентності при титруванні сильної основи сильною кислотою знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.16. Точка еквівалентності при титруванні слабкої кислоти лугом знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.17. Точка еквівалентності при титруванні слабкої основи сильною кислотою знаходиьться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.18. Що таке зворотне титрування?
а) в присутності індикатора титрування робочого розчину досліджуваним розчином;
б) титрування надлишку робочого розчину, доданого до досліджуваного;
в) титрування в присутності індикатора робочим розчином досліджуваний розчин.
2.5.19. На яких реакціях ґрунтуються титриметричні методи ацидиметрії і алкаліметрії?
а) на реакціях нейтралізації кислот, фенолів, амінів, амінокислот, основ.
б) на реакціях осадження в певному середовищі (рН);
в) на окисно-відновних реакціях за участю окисників і відновників.
1.5.20. Які класи речовини можна визначити методом ацидиметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.21. Які класи речовин можна визначити методом алкаліметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.22. Чи можна розрахувати молярну концентрацію еквіваленту речовини в розчині за результатами титриметричного (об’ємного) аналізу?
а) так; б) ні;
в) тільки за масою наважки.
1.5.23. Чи можливо за точною наважкою КОН приготувати «стандартний розчин» для титриметричного аналізу?
а) так; б) ні; в) після попередньої очистки.
1.5.24. Ацидиметрія – це метод визначення вмісту:
а) основ у розчині титруванням стандартним розчином кислот;
б) багатоосновних кислот у розчині титруванням розчином натрій гідроксиду;
в) кислот у розчині титруванням стандартним розчином основ;
г) гідросульфітів у розчині титруванням стандартним розчином натрій гідроксиду.
1.5.25. В методі ацидометрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.26. Методом ацидометрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.27. В методі алкаліметрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.28. Методом алкаліметрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.29. Розчин якої речовини використовується як титрант при алкаліметричному визначенні:
а) натрій гідроксиду; б) хлоридної кислоти;
в) натрій хлориду; г) сульфітної кислоти.
1.5.29. Кислотність шлункового соку визначають у клінічних одиницях (к.о.), які виражаються об’ємом:
а) 0,1М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
б) 0,1М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку;
в) 0,01М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
г) 0,01М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку.
1.5.30. Загальна кислотність є:
а) вищою за вільну кислотність;
б) нищою за вільну кислотність;
в) рівною вільній кислотністі;
г) нищою за зв’язану кислотність.
1.5.31. Чому дорівнює молярна маса еквівалента сульфатної кислоти у реакції з натрій гідроксидом:
а) 49 г/моль; б) 98 г/моль;
в) 196 г/моль; г) 49 г.
1.5.32. Чому дорівнює молярна маса еквівалента хлоридної кислоти у реакції з кальцій гідроксидом:
а) 36,5 г/моль; б) 18,25 г/моль;
в) 36 г; г) 73 г/моль.
1.5.33. Чому дорівнює молярна маса еквівалента натрій гідроксиду у реакції з сульфатною кислотою:
а) 20 г/моль; б) 40 г/моль;
в) 40 г; г) 80 г/моль.
1.5.34. Молярна маса еквіваленту Al2(SO4)3 складає (г/моль):
а) 171; б) 114; в) 57; г) 342.
1.5.35. Чому дорівнює молярна маса еквівалента аміаку у реакції з хлоридною кислотою:
а) 17 г/моль; б) 34 г/моль;
в) 2 моль; г) 14 г/моль.
1.5.36. Вкажіть фактор еквівалентності fекв. оксалатної кислоти у реакції:
Н2С2О4 + 2NaOH = Na2С2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.37. Вкажіть фактор еквівалентності fекв. натрій гідроксиду у реакції:
Н2С2О4 + 2NaOH = NaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.38. Вкажіть фактор еквівалентності fекв. сульфатної кислоти у реакції з амоній гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.39. Вкажіть фактор еквівалентності fекв. амоній гідроксиду у реакції з хлоридною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.40. Вкажіть фактор еквівалентності fекв. кальцій гідроксиду у реакції з сульфатною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.41. Вкажіть фактор еквівалентності fекв. ацетатної кислоти у реакції з барій гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.42. Вкажіть фактор еквівалентності fекв. барій гідроксиду у реакції з оксалатною кислотою:
Н2С2О4 + Вa(OH)2 = ВaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.43. Тимчасова твердість води обумовлена наявністю в ній солей:
а) Na2CO3 і CaCO3; б) Ca(HCO3)2 і MgSO4;
в) Ca(HCO3)2 Mg(HCO3)2.
1.5.44. Постійна твердість води обумовлена наявністю в ній солей:
а) CaCl2, MgSO4; б) CaCO3, MgCO3;
в) MgSO4, CaCO3
1.5.45. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.46. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.47. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.48. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.49 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.50. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.51. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.52. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.53. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.54 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.55. Одним з показників якості води, що використовується у фармацевтичній промисловості, є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
*а) MgCl2; б) KCl;
в) Ca(HCO3)2; г) Mg(HCO3)2
1.5.56. У фармацевтичному аналізі, в якості титранту використовують 0,1 М розчин хлоридної кислоти. Який об'єм цієї кислоти можна приготувати виходячи з 100 мл 0,5 М розчину HCl?
*а) 500мл; б) 50 мл;
в) 200 мл; г) 1000 мл.
1.5.57. Титриметричний метод аналізу – це метод:
а) кількісного аналізу кислот, основ, солей;
б) кількісного аналізу досліджуваного розчину в процесі титрування;
в) якісного аналізу кислот, основ, солей в процесі титрування.
1.5.58. Процес титрування – це:
а) повільне додавання одного розчину до іншого;
б) повільне додавання одного розчину до іншого до настання еквівалентної
точки;
в) повільне додавання одного розчину до води.
1.5.59. Вимоги, до реакцій в титриметричному аналізі:
а) повинні проходити швидко, кількісно, не бути зворотніми; можливість встановлення еквівалентної точки;
б) повинні проходити швидко, кількісно, бути зворотніми;
в) повинні проходити повільно, кількісно, не бути зворотніми, можливість встановлення еквівалентної кількості.
1.5.60. Точну концентрацію за даними титрування розраховують за формулою:
а) 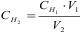 ; б)
; б) 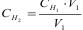 ;
;
в) 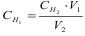
1.5.61. Для приготування титрованих розчинів використовують:
а) мірний циліндр; б) мірну колбу;
в) мірний хімічний стакан; г) піпетку.
1.5.62. Який хімічний посуд використовують для відбору проби для титрування:
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2274; Нарушение авторских прав?; Мы поможем в написании вашей работы!